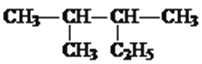��Ŀ����
����Ŀ������A��B��C��D��E��F���ֶ���������Ԫ�أ�ԭ����������������֪A����̬�⻯������������������ˮ���ﷴӦ��Bԭ�������������ǵ��Ӳ�����3����C+��D3+���ӵĵ��Ӳ�ṹ��ͬ��B��E����ͬһ���塣
��ش��������⣺
��1��E��Ԫ�����ڱ��е�λ����_______________��
��2������Ԫ���γɵļ������У��뾶��С����____________________�������ӷ��ţ���
��3��������Ԫ���е�һ�ֻ�����ɵ����ʼ��Է������·�Ӧ��

�����Ҿ���Ư���ԣ����ҵĵ���ʽΪ__________��
��������ˮ��Һ��ǿ������Һ�����Ϊ___________��__________���ѧʽ����
������Ϊ��Ԫ���ᣬ����������ǿ�ᡢ��������ǿ����ҵ�����Ϊ_________���õ��뷽��ʽ��ʾ����������ǿ�ᡢ��������ǿ���ԭ��______________________________��
������������Ϊ����ɫ����ͬѧ��Ϊ��Ũ������Ը������������Ϊ��֤��۵��Ƿ���ȷ��������װ�ý���ʵ��ʱ����Һ©����Ӧ����_________�����Լ����ƣ���ʵ������У�Ũ������δ�����������ݳ�������Һ��Ϊ����ɫ���ɴ˵ó��Ľ�����_________________��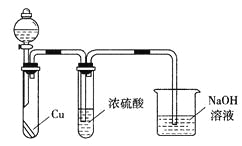
���𰸡���1���������ڣ���A��
��2��![]()
��3����![]() ��Na��Na2O2
��Na��Na2O2
���Ȼ���![]()
![]()
![]()
![]()
![]()
![]()
��Ũ���� Ũ����ܸ��������������
�����������������A����̬�⻯������������������ˮ���ﷴӦ��A��NԪ�أ�Bԭ�������������ǵ��Ӳ�����3����B��OԪ�أ�B��E����ͬһ���壬E��SԪ�أ�C+��D3+���ӵĵ��Ӳ�ṹ��ͬ��C��Na��D��Al�����ֶ���������Ԫ�أ�ԭ��������������F��ClԪ�ء���1��S��Ԫ�����ڱ��е�λ���ǵ������ڣ���A�壻��2�����Ӳ���Խ�ٰ뾶ԽС��������ͬʱ��ԭ������Խ��뾶ԽС������Ԫ���γɵļ������У��뾶��С����![]() ����3�������Ҿ���Ư���ԣ�˵���������������Ǵ����ᣬ���ҵĵ���ʽΪ
����3�������Ҿ���Ư���ԣ�˵���������������Ǵ����ᣬ���ҵĵ���ʽΪ![]() ��������ˮ��Һ��ǿ������Һ�����Ϊ�������ƣ����Լ�ΪNa��Na2O2��������Ϊ��Ԫ���ᣬ�����Ȼ���
��������ˮ��Һ��ǿ������Һ�����Ϊ�������ƣ����Լ�ΪNa��Na2O2��������Ϊ��Ԫ���ᣬ�����Ȼ���![]() ������������ǿ�ᡢ��������ǿ����Ա�����������������������������������ܷ�����ʽ�������ܷ�����ʽ���룬���Ա���������ǿ�ᡢ��������ǿ��
������������ǿ�ᡢ��������ǿ����Ա�����������������������������������ܷ�����ʽ�������ܷ�����ʽ���룬���Ա���������ǿ�ᡢ��������ǿ��![]()
![]()
![]()
![]()
![]() ��������������Ϊ����ɫ������NO�������NO2��ͭ��Ũ���ᷴӦ����NO2����Һ©����Ӧ����Ũ���ᡣʵ������У�Ũ������δ�����������ݳ�������Һ��Ϊ����ɫ���ɴ˵ó��Ľ�����Ũ����ܸ������������
��������������Ϊ����ɫ������NO�������NO2��ͭ��Ũ���ᷴӦ����NO2����Һ©����Ӧ����Ũ���ᡣʵ������У�Ũ������δ�����������ݳ�������Һ��Ϊ����ɫ���ɴ˵ó��Ľ�����Ũ����ܸ������������

����Ŀ��
��Ʒ�� | GB5461 |
��Ʒ�ȼ� | һ�� |
�� �� | ʳ�Ρ�����ء������ |
�⺬������I�ƣ� | 20��50mg/kg |
��1���������⻯�������������·������·�Ӧ����ƽ��ѧ����ʽ������ѧ���������ڿհ״���
KIO3+ KI+ H2SO4= K2SO4+ I2+ H2O
��2��������Ӧ���ɵ�I2�������Ȼ�̼���顣�������Ȼ�̼��Һ�м���Na2SO3ϡ��Һ����I2��ԭ���Ի������Ȼ�̼��
��Na2SO3ϡ��Һ��I2��Ӧ�����ӷ���ʽ�� ��
��ijѧ����ƻ������Ȼ�̼�IJ���Ϊ��
a����������Ȼ�̼��Һ���ڷ�Һ©���У�
b����������Na2SO3ϡ��Һ��
c��������²�Һ�壻
d������Һ©���������
���з�Һ©��ʹ��ǰ����еIJ����� ������������ȷ��˳���� (����ţ�
��3����֪��I2+2S2O32���T2I��+S4O62����ijѧ���ⶨʳ�þ����εĵ⺬�����䲽��Ϊ��
a��ȷ��ȡwgʳ�Σ�����������ˮʹ����ȫ�ܽ⣻
b����ϡ�����ữ������Һ����������KI��Һ��ʹKIO3��KI��Ӧ��ȫ��
c���Ե���Ϊָʾ������μ������ʵ���Ũ��Ϊ2.0��10��3mol�� L��1��Na2S2O3��Һ10.0mL��ǡ�÷�Ӧ��ȫ��
���ж�c�з�Ӧǡ����ȫ���ݵ������� ��
��b�з�Ӧ��������I2�����ʵ����� mol��
����������ʵ��Ͱ�װ��˵�������⾫���εĵ⺬���ǣ��Ժ�w�Ĵ���ʽ��ʾ�� mg/kg��