题目内容
11.单晶硅是信息产业中重要的基础材料.工业上可用焦炭与二氧化硅的混合物在高温下与氯气反应生成SiCl4和CO,SiCl4经提纯后用氢气还原得高纯硅.如图是实验室制备SiCl4的装置示意图.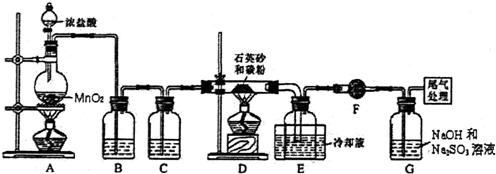
已知SiCl4的熔点为-70.0℃,沸点为57.7℃,且遇水易反应,
请回答下列问题:
(1)写出装置A中发生反应的离子方程式:MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2H2O+Cl2↑
(2)装置B中的试剂是饱和食盐水;装置C的作用为干燥氯气
(3)装置D的玻璃管中发生主要反应的化学方程式是SiO2+2C+2Cl2$\frac{\underline{\;\;△\;\;}}{\;}$SiCl4+2CO,装置F的作用为防止F右端的水蒸气进入E与四氯化硅反应,造成产物不纯.
(4)G中吸收气体一段时间后,吸收液中肯定存在OH-、Cl-和SO42-.为探究该吸收液中可能存在的其它酸根离子(忽略空气中CO2的影响),研究小组实验设计如下
【提出假设】假设1:只有SO32-:假设2:既无SO32-也无ClO-;假设3:只有ClO-:
【设计方案,进行试验】可供选择的实验试剂有:3mol/L H2SO4溶液、1mol/L NaOH溶液、品红溶液、0.01mol/L KMnO4溶液、淀粉-KI溶液.各取少量吸收液于a、b、c三支试管中,分别滴加3mol/L H2SO4酸化后,进行下列实验:
请完成如表:
| 序号 | 操作 | 可能出现的现象 | 结论 |
| ① | 向a试管中滴加几滴0.01mol/L的KMnO4 | 若溶液褪色 | 则假设1成立 |
| 若溶液不褪色 | 则假设2或3成立 | ||
| ② | 向b试管中滴加几滴品红 | 若溶液褪色 | 则假设1或3成立 |
| 若溶液不褪色 | 则假设2成立 | ||
| ③ | 向c试管中滴加几滴淀粉-KI溶液 | 则假设3成立 |
分析 制备四氯化硅的实验流程:A中发生二氧化锰与浓盐酸的反应生成氯气,MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2H2O+Cl2↑,B中饱和实验水除去HCl,C装置中浓硫酸干燥氯气,D中发生Si与氯气的反应生成四氯化硅,由信息可知,四氯化硅的沸点低,则E装置冷却可收集四氯化硅,F可防止防止F右端的水蒸气进入E与四氯化硅反应,造成产物不纯,最后G处理含氯气的尾气.
(1)二氧化锰和浓盐酸发生氧化还原反应生成氯化锰、氯气和水;
(2)A中制得的氯气中含有氯化氢和水蒸气杂质,要除去,用饱和食盐水除去氯化氢,用浓硫酸干燥氯气;
(3)在D装置中二氧化硅和碳和氯气反应生成四氯化硅和一氧化碳;四氯化硅遇水极易水解,F可防止空气中的水进入;
(4)由假设1和假设2可知,要检测的为SO32-和ClO-,故假设3为只有ClO-,又因为SO32-会使KMnO4溶液(或溴水)褪色,而ClO-不会,所故可以用来检测假设1,H2SO3和ClO-具有漂白性,会使品红溶液褪色,所以可以用来检测假设2,ClO-可以氧化KI反应生成碘单质,遇到淀粉边蓝色,可以用来检测假设3.
解答 解:(1)装置A是氯气发生装置,A中二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水,其离子方程式为MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2H2O+Cl2↑,
故答案为:MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2H2O+Cl2↑;
(2)A中制得的氯气中含有氯化氢和水蒸气杂质,要除去,用饱和食盐水除去氯化氢,用浓硫酸干燥氯气,所以B中装有饱和食盐水,装置C干燥氯气,
故答案为:饱和食盐水;干燥氯气;
(3)在D装置中二氧化硅和碳和氯气反应生成四氯化硅和一氧化碳,反应为:SiO2+2C+2Cl2$\frac{\underline{\;\;△\;\;}}{\;}$SiCl4+2CO,四氯化硅遇水极易水解,F可防止右端的水蒸气进入E与四氯化硅反应,造成产物不纯,
故答案为:SiO2+2C+2Cl2$\frac{\underline{\;\;△\;\;}}{\;}$SiCl4+2CO;防止F右端的水蒸气进入E与四氯化硅反应,造成产物不纯;
(4)由假设1和假设2可知,要检测的为SO32-和ClO-,故假设3为只有ClO-,又因为SO32-会使KMnO4溶液褪色,而ClO-不会,所故可以用来检测假设1,H2SO3和ClO-具有漂白性,会使品红溶液褪色,所以可以用来检测假设2,ClO-可以氧化KI反应生成碘单质,遇到淀粉边蓝色,可以用来检测假设3,
故答案为:①0.01mol/L的KMnO4;②品红;③淀粉-KI溶液;若溶液变为蓝色.
点评 本题考查制备实验方案的设计,综合了氯气的制法、硅的提纯等实验知识,注意把握制备原理及实验流程中的反应、物质的性质等为解答的关键,侧重分析与实验能力的综合考查,题目难度中等.

 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 在水中的溶解度 | 微溶 | 微溶 | 微溶 |
步骤1:在a中加入15mL苯和少量铁屑,再将b中4.0mL液溴慢慢加入到a中.
步骤2:充分反应后,向a中加入10mL水,然后过滤除去未反应的铁屑.
步骤3:滤液依次用10mL水、8mL 10%的NaOH溶液、10mL 水洗涤,分液得粗溴苯.
步骤4:向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤即得粗产品.
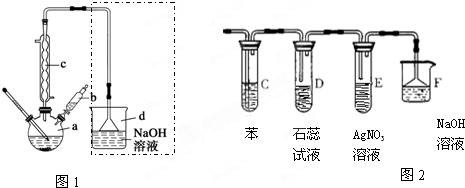
(1)步骤1仪器a中发生的主要化学反应方程式为:C6H6+Br2$\stackrel{FeBr_{3}}{→}$C6H5Br+HBr.
(2)仪器c的作用是冷凝回流,回流的主要物质有:C6H6、Br2.
(3)步骤3中NaOH所发生的主要反应是:Br2+2NaOH=NaBr+NaBrO+H2O.
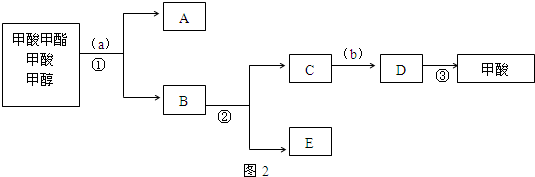
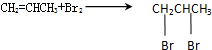
(4)若将图1虚线框部分改为图2装置,则 D、E可以检验出来的物质是HBr,其中试管C中苯的作用是吸收溴蒸气,能否据此判断发生了取代反应?是(填“是”或“否”).
| A. | 向明矾(KAl(SO4)2•12H2O)溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ | |
| B. | Fe3O4溶于足量稀HNO3:Fe3O4+8H+=Fe2++2Fe3++4H2O | |
| C. | 玻璃试剂瓶被烧碱溶液腐蚀:SiO2+2Na++2OH-=Na2SiO3↓+H2O | |
| D. | VO2+与酸性高锰酸钾溶液反应:5VO2++MnO4-+H2O═5VO2++Mn2++2H+ |
| 物质 | 所含杂质 | 除去杂质的方法 | |
| A | CO气体 | CO2 | 通过足量氢氧化钠溶液,并干燥 |
| B | NaOH溶液 | Na2CO3 | 加入足量稀盐酸至不再产生气泡 |
| C | CaO固体 | CaCO3 | 加水溶解,过滤 |
| D | FeSO4溶液 | CuSO4 | 加入足量锌粒,充分反应,过滤 |
| A. | A | B. | B | C. | C | D. | D |
 A,B,C,D,E是五种短周期元素,A,B,C,D,E分别代表元素符号,他们的原子序数依次增大,A是元素周期表中半径最小的元素;B元素最高价氧化物对应的水化物与其氢化物反应生成一种盐;D与A同主族,且与E同周期;E元素最外层电子数是其次外层电子数的$\frac{3}{4}$;C与E同主族.请回答下列问题:
A,B,C,D,E是五种短周期元素,A,B,C,D,E分别代表元素符号,他们的原子序数依次增大,A是元素周期表中半径最小的元素;B元素最高价氧化物对应的水化物与其氢化物反应生成一种盐;D与A同主族,且与E同周期;E元素最外层电子数是其次外层电子数的$\frac{3}{4}$;C与E同主族.请回答下列问题:


 、
、 .
.