��Ŀ����
19������������׳ơ������������������մ����н�ǿ�Ļ�ԭ�Ժ���λ�������dz�ϴ�����Ƭ�Ķ�Ӱ������֯��Ư������ȼ������������еĻ�ԭ������������ƣ�Na2S2O3�������������ƺ����ͨ�����Ϸ�Ӧ�Ƶã�װ����ͼ��a����ʾ��
��֪��Na2S2O3��������Һ�в����ȶ����ڣ��й����ʵ��ܽ��������ͼ��b����ʾ��
��1��Na2S2O3•5H2O���Ʊ���
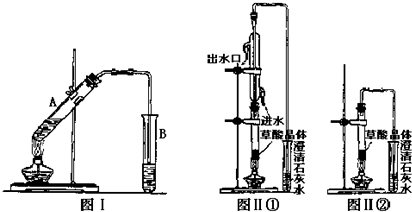
����1����ͼ���Ӻ�װ�ú��A��Cװ�������ԵIJ����ǹرշ�Һ©����������D���ƿ�м�ˮ����û�����ܣ���K1���ر�K2���þƾ�����Բ����ƿ����D�����ܿ������ݲ�����ֹͣ���Ⱥ������γ�һ��ˮ����˵������������
����2������ҩƷ����K1���ر�K2�����ȣ�װ��B��D�е�ҩƷ��ѡ�����������е�ACD�������ţ�
A��NaOH��Һ B��ŨH2SO4 C������KMnO4��Һ D������NaHCO3��Һ
����3��C�л��Һ��������������Ӧһ��ʱ�����۵������٣���C����Һ��pH�ӽ���С��7ʱ����K2���ر�K1��ֹͣ���ȣ�C����ҺҪ����pH��������Na2S2O3��������Һ�в����ȶ����ڣ�
����4������C�еĻ��Һ������Һ��������Ũ������ȴ�ᾧ�����ˡ�ϴ�ӡ���ɣ��õ���Ʒ��
��2��Na2S2O3���ʵļ��飺��������������ˮ�еμ�Na2S2O3��Һ����ˮ��ɫ��dz��д���÷�Ӧ�Ļ�ѧ����ʽNa2S2O3+4Cl2+5H2O=Na2SO4+H2SO4+8HCl��������Һ�еμ���������Һ���۲쵽�а�ɫ�����������ݴ���ΪNa2S2O3���л�ԭ�ԣ��÷����Ƿ���ȷ��˵�����ɲ���ȷ����Ϊ��ˮ�к��������ӣ�
��3������Na2S2O3��Һ�ⶨ��ˮ��Ba2+Ũ�ȣ��������£�ȡ��ˮ25.00mL�������ʵ�����ȼ�������K2Cr2O7��Һ����BaCrO4���������ˡ�ϴ�Ӻ�������ϡ�����ܽ⣮��ʱCrO42-ȫ��ת��ΪCr2O72-���ټӹ���KI��Һ����ַ�Ӧ���������Һ��ָʾ������0.010mol•L-1��Na2S2O3��Һ���еζ�����Ӧ��ȫʱ������Na2S2O3��Һ18.00mL�����ַ�Ӧ�����ӷ���ʽΪ����Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O�� ��I2+2S2O32-=2I-+S4O62-��÷�ˮ��Ba2+�����ʵ���Ũ��Ϊ2.4��10-3mol•L-1��
���� ͼ��a���У����������£�ͭ��Ũ���ᷢ��������ԭ��Ӧ���ɶ�����������ͭ��ˮ�����������̼���ơ�S��C�з�Ӧ������������ƣ�������������������������ж�������ֱ���ſգ�Ӧ���ü�Һ���գ�
��1������1������ѹǿ�����װ�õ������ԣ�
����2������������л�ԭ�ԣ�����������������ж�������ֱ���ſգ����������Ը��������Һ�������Һ���գ�
����3��Na2S2O3��������Һ�в����ȶ����ڣ��ڼ����������ȶ����ڣ�
����4������Һ�л�ȡ���ʣ���Ҫ��������Ũ������ȴ�ᾧ�����˵ķ�����
��2����������ǿ�����ԣ���������ƾ��л�ԭ�ԣ����߷���������ԭ��Ӧ���������ơ���������
��ˮ�к��������ӣ�Ӱ����������ƻ�ԭ�Ե��жϣ�
��3���������֪��BaCrO4�������ܽ�ת��ΪCr2O2-7����Ԫ���غ㼰��֪����ʽ�ɵù�ϵʽ��2Ba2+��2BaCrO4��Cr2O2-7��3I2��6Na2S2O3��������ĵ�Na2S2O3���ù�ϵʽ������Һ��n��Ba2+������������c��Ba2+����
��� �⣺ͼ��a���У����������£�ͭ��Ũ���ᷢ��������ԭ��Ӧ���ɶ�����������ͭ��ˮ�����������̼���ơ�S��C�з�Ӧ������������ƣ�������������������������ж�������ֱ���ſգ�Ӧ���ü�Һ���գ�
��1������1�������Լ��鷽��Ϊ�رշ�Һ©����������D���ƿ�м�ˮ����û�����ܣ���K1���ر�K2���þƾ�����Բ����ƿ����D�����ܿ������ݲ�����ֹͣ���Ⱥ������γ�һ��ˮ����˵�����������ã�
����2������������л�ԭ�ԣ�����������������ж�������ֱ���ſգ����������Ը��������Һ�����������Ը��������Һ���գ����������Դ���̼�ᣬ�����ܺ�̼�����ơ�NaOH��Һ��Ӧ��������������Һ��̼��������Һ���գ�
����3��Na2S2O3��������Һ�в����ȶ����ڣ��ڼ������������ȶ����ڣ�Ϊ�˷�ֹ��������Ʒ�����Ӧ��Ҫ������Һ��pH�ӽ���С��7��
����4������Һ�л�ȡ���ʣ���Ҫ��������Ũ������ȴ�ᾧ�����˵ķ�����
�ʴ�Ϊ���رշ�Һ©����������D���ƿ�м�ˮ����û�����ܣ���K1���ر�K2���þƾ�����Բ����ƿ����D�����ܿ������ݲ�����ֹͣ���Ⱥ������γ�һ��ˮ����˵�����������ã�
ACD���ӽ���С��7��Na2S2O3��������Һ�в����ȶ����ڣ�����Ũ������ȴ�ᾧ��
��2����������ǿ�����ԣ���������ƾ��л�ԭ�ԣ����߷���������ԭ��Ӧ���������ơ���������ᣬ��Ӧ����ʽΪNa2S2O3+4Cl2+5H2O=Na2SO4+H2SO4+8HCl��
��ˮ�к��������ӣ�Ӱ����������ƻ�ԭ�Ե��жϣ����Բ���ȷ��
�ʴ�Ϊ��Na2S2O3+4Cl2+5H2O=Na2SO4+H2SO4+8HCl������ȷ����Ϊ��ˮ�к��������ӣ�
��3���������֪��BaCrO4�������ܽ�ת��ΪCr2O2-7����Ԫ���غ㼰��֪����ʽ�ɵù�ϵʽ��2Ba2+��2BaCrO4��Cr2O2-7��3I2��6Na2S2O3�����ĵ�Na2S2O3Ϊ0.018L��0.01mol/L����n��Ba2+��=0.018L��0.01mol/L��$\frac{1}{3}$=0.00006mol������Һ��c��Ba2+��=$\frac{6��1{0}^{-5}mol}{0.025L}$=2.4��10-3 mol•L-1��
�ʴ�Ϊ��2.4��10-3 mol•L-1��
���� ���⿼�������Ʊ�ʵ�鷽����ƣ�Ϊ��Ƶ���㣬�漰�����Լ��顢��ʵ��װ�ü�����ķ������ۡ����ʵķ����ᴿ��������ԭ��Ӧ�ζ���ע��ͼa�и���װ�õ����ü������ķ�Ӧ���ѵ���ȷ����3���и���������֮��Ĺ�ϵ����Ŀ�Ѷ��еȣ�

 ȫ��������ϵ�д�
ȫ��������ϵ�д� һ��һ����ʱ���ϵ�д�
һ��һ����ʱ���ϵ�д�C3H8��g��+5O2��g���T3CO2��g��+4H2O��l����H1=-a kJ•mol-1 ��
C3H8��g��+5O2��g���T3CO2��g��+4H2O��g����H2=-b kJ•mol-1 ��
�����ж���ȷ���ǣ�������
| A�� | ��H1����H2 | B�� | a=b | C�� | a��b | D�� | a��b |
��һ��ԭ�ϡ���Ӧ������ƽ��ת���ʡ��ղ���
| ��Ȳˮ���� | ��ϩ������ | |
| ԭ�� | ��Ȳ��ˮ | ��ϩ������ |
| ��Ӧ���� | HgSO4��100��125�� | PdCl2-CuCl2��100��125�� |
| ƽ��ת���� | ��Ȳƽ��ת����90%���� | ��ϩƽ��ת����80%���� |
| �ղ��� | 2.5�֣�ij�豸�����£� | 3.6�֣���ͬ�豸�����£� |
| ԭ���������չ��� | |
| ��Ȳ | CaCO3$\stackrel{��850-1100��}{��}$CaO$��_{1100��}^{��+C����¯}$CaC2$\stackrel{�۱���ʳ��ˮ}{��}$C2H2 |
| ��ϩ | ��Դ��ʯ���ѽ��� |
��1��д�����л�ѧ����ʽ��
a����Ȳˮ��������ȩCH��CH+H2O$��_{��}^{����}$CH3CHO��
b����ϩ����������ȩ2CH2=CH2+O2$��_{��}^{����}$2CH3CHO��
��2���������з������ִ���ҵ����ϩ��������ȡ����Ȳˮ�������������ܵ�ԭ�ӻ�����ԭ����Դ���ܺĵȽǶȷ�������дһ�㣩�����߷�Ӧ�����¶��൱������Ȳˮ��������ȩʹ�õ��ǹ��δ��������εĶ��Դ���Ȼ��ϩ��������ת������С����Ȳˮ����������Ӧ�졢�ղ�������ߵö࣬��Ȳ����ȡҪ�����ಽ��Ӧ�Ƶã������Ĵ��������ܡ����ܣ�������ϩ��Դ��ʯ���ѽ��������ĵ�����������Ȳ�٣��ҽ�����õȣ�
��3���ӻ�ѧ��Ӧ���ʽǶȷ���������ͬ�����£�������ȡ��ȩ�ķ������ֿ죿��ϩ�������죮
��4�������������ַ����ķ�Ӧ�����������ӡ�100��������ѹ����ԭ��ת���ʻ�������һЩ������ʵ��������ȴ�����������ķ�������������Ϊ���ַ�������ͬ��Ӧ�����£�ת�����Ѿ��ܸߣ�����ѹǿ�����������������豸Ԥ�㣬�����ã�
��5�����ij��������ϩΪԭ�ϣ�ͨ��3�������Ƶþ�����ϩ����д�������ķ�Ӧ����ʽ�����Լ����ܼ�����ѡ���Ĺ����в�����ȡ����Ӧ��
 ��
�� 
��֪SiCl4���۵�Ϊ-70.0�棬�е�Ϊ57.7�棬����ˮ��Ӧ��
��ش��������⣺
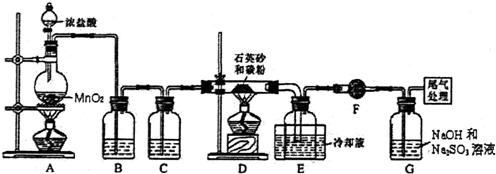
��1��д��װ��A�з�����Ӧ�����ӷ���ʽ��MnO2+4H++2Cl- $\frac{\underline{\;\;��\;\;}}{\;}$Mn2++2H2O+Cl2��
��2��װ��B�е��Լ��DZ���ʳ��ˮ��װ��C������Ϊ��������
��3��װ��D�IJ������з�����Ҫ��Ӧ�Ļ�ѧ����ʽ��SiO2+2C+2Cl2$\frac{\underline{\;\;��\;\;}}{\;}$SiCl4+2CO��װ��F������Ϊ��ֹF�Ҷ˵�ˮ��������E�����Ȼ��跴Ӧ����ɲ��ﲻ����
��4��G����������һ��ʱ�������Һ�п϶�����OH-��Cl-��SO42-��Ϊ̽��������Һ�п��ܴ��ڵ�����������ӣ����Կ�����CO2��Ӱ�죩���о�С��ʵ���������
��������衿����1��ֻ��SO32-������2������SO32-Ҳ��ClO-������3��ֻ��ClO-��
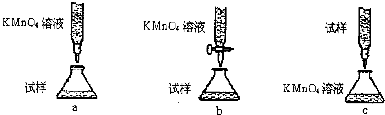
����Ʒ������������顿�ɹ�ѡ���ʵ���Լ��У�3mol/L H2SO4��Һ��1mol/L NaOH��Һ��Ʒ����Һ��0.01mol/L KMnO4��Һ������-KI��Һ����ȡ��������Һ��a��b��c��֧�Թ��У��ֱ�μ�3mol/L H2SO4�ữ��������ʵ�飺
����������
| ��� | ���� | ���ܳ��ֵ����� | ���� |
| �� | ��a�Թ��еμӼ���0.01mol/L��KMnO4 | ����Һ��ɫ | �����1���� |
| ����Һ����ɫ | �����2��3���� | ||
| �� | ��b�Թ��еμӼ���Ʒ�� | ����Һ��ɫ | �����1��3���� |
| ����Һ����ɫ | �����2���� | ||
| �� | ��c�Թ��еμӼ��ε���-KI��Һ | �����3���� |
| A�� | CuCl2��Һ | B�� | NaCl��Һ | C�� | MgSO4��Һ | D�� | K2CO3��Һ |

 ��
��