题目内容
3.溴苯是一种常用的化工原料,通常以苯和溴为原料制取,查资料知:| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 在水中的溶解度 | 微溶 | 微溶 | 微溶 |
步骤1:在a中加入15mL苯和少量铁屑,再将b中4.0mL液溴慢慢加入到a中.
步骤2:充分反应后,向a中加入10mL水,然后过滤除去未反应的铁屑.
步骤3:滤液依次用10mL水、8mL 10%的NaOH溶液、10mL 水洗涤,分液得粗溴苯.
步骤4:向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤即得粗产品.
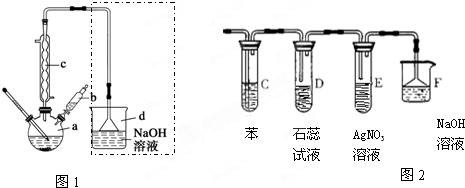
(1)步骤1仪器a中发生的主要化学反应方程式为:C6H6+Br2$\stackrel{FeBr_{3}}{→}$C6H5Br+HBr.
(2)仪器c的作用是冷凝回流,回流的主要物质有:C6H6、Br2.
(3)步骤3中NaOH所发生的主要反应是:Br2+2NaOH=NaBr+NaBrO+H2O.
(4)若将图1虚线框部分改为图2装置,则 D、E可以检验出来的物质是HBr,其中试管C中苯的作用是吸收溴蒸气,能否据此判断发生了取代反应?是(填“是”或“否”).
分析 (1)苯和纯溴在三氯化铁催化剂作用下,苯环上一个氢原子发生取代反应生成溴苯和溴化氢;
(2)根据表中数据可知,苯和液溴的沸点较低,容易变成气体挥发出来;
(3)溴苯含有少量的溴和溴化氢,可以用NaOH溶液除去,步骤3中NaOH所发生主要反应为溴单质与氢氧化钠的反应;
(4)实验室制备溴苯是用苯和液溴在铁粉作催化剂的条件下发生取代反应生成溴苯和溴化氢,根据装置图可知,生成溴苯的同进还有溴化氢生成另外还有少部分溴挥发,所以图2中:试管C中苯的作用是吸收溴蒸气,在D装置中石蕊会变红,E中的硝酸银会产生溴化银沉淀,尾气用氢氧化钠溶液吸收,由于溴化氢极易溶于水,用倒扣的漏斗防止倒吸,因E中的硝酸银产生溴化银沉淀,可判断发生取代反应.
解答 解:(1)苯和纯溴在三溴化铁催化剂作用下,苯环上一个氢原子发生取代反应生成溴苯和溴化氢,C6H6+Br2$\stackrel{FeBr_{3}}{→}$C6H5Br+HBr,
故答案为:C6H6+Br2$\stackrel{FeBr_{3}}{→}$C6H5Br+HBr;
(2)苯的沸点为80℃,溴的沸点为59℃,二者沸点较低,容易挥发出来,冷凝器冷凝回流的主要物质为:C6H6、Br2,
故答案为:C6H6、Br2;
(3)由于溴苯中溶有溴化氢与单质溴,所以氢氧化钠溶液的作用是吸收HBr和Br2,发生反应的化学方程式为Br2+2NaOH=NaBr+NaBrO+H2O、HBr+NaOH=NaBr+H2O,主要反应为溴单质与氢氧化钠的反应,
故答案为:Br2+2NaOH=NaBr+NaBrO+H2O;
(4)液溴易挥发,溴极易溶于苯,用苯除去溴化氢气体中的溴蒸气,以防干扰检验H+和Br-,将图1虚线框部分改为图2装置,因苯易吸收溴单质,所以试管C中苯的作用是吸收溴蒸气,酸能使紫色石蕊试液变红,在D装置中石蕊会变红,是因为C6H6+Br2$\stackrel{FeBr_{3}}{→}$C6H5Br+HBr,溴化氢溶液使石蕊变红,E试管内装的试剂的作用为检验生成的溴化氢,因溴化氢易溶于水,溶解于水的溴化氢电离出的溴离子和银离子反应,AgNO3+HBr=AgBr↓,生成淡黄色不溶于硝酸的沉淀溴化银,所以D、E可以检验出来的物质是HBr,因E中的硝酸银产生溴化银沉淀,可判断发生取代反应,
故答案为:HBr;吸收溴蒸气;是.
点评 本题考查了苯的性质、制备实验方案的设计,题目难度中等,涉及了溴苯的制取实验、物质的分离提纯等,清楚制备的原理是解答的关键,充分培养了学生的分析、理解能力及灵活应用所学知识解决问题的能力.

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案| A. | 再通入少量氯气,$\frac{c({H}^{+})}{c(Cl{O}^{-})}$减小 | |
| B. | 光照一段时间氯水,溶液的pH值增大 | |
| C. | 加入少量固体AgNO3,溶液的pH值减小 | |
| D. | 加入少量水,水的电离平衡向右移动 |
表一:原料、反应条件、平衡转化率、日产量
| 乙炔水化法 | 乙烯氧化法 | |
| 原料 | 乙炔、水 | 乙烯、空气 |
| 反应条件 | HgSO4、100~125℃ | PdCl2-CuCl2、100~125℃ |
| 平衡转化率 | 乙炔平衡转化率90%左右 | 乙烯平衡转化率80%左右 |
| 日产量 | 2.5吨(某设备条件下) | 3.6吨(相同设备条件下) |
| 原料生产工艺过程 | |
| 乙炔 | CaCO3$\stackrel{①850-1100℃}{→}$CaO$→_{1100℃}^{②+C、电炉}$CaC2$\stackrel{③饱和食盐水}{→}$C2H2 |
| 乙烯 | 来源于石油裂解气 |
(1)写出下列化学方程式:
a.乙炔水化法制乙醛CH≡CH+H2O$→_{△}^{催化剂}$CH3CHO.
b.乙烯氧化法制乙醛2CH2=CH2+O2$→_{△}^{催化剂}$2CH3CHO.
(2)从两表中分析,现代工业上乙烯氧化法逐步取代乙炔水化法,分析可能的原因(从环境、原料来源、能耗等角度分析,任写一点):两者反应条件温度相当,但乙炔水化法制乙醛使用的是汞盐催化剂,汞盐的毒性大,虽然乙烯氧化法的转化率略小于乙炔水化法,但反应快、日产量比其高得多,乙炔的制取要经过多步反应制得,且消耗大量的热能、电能,但是乙烯来源于石油裂解气,消耗的总能量比乙炔少,且较容易获得等.
(3)从化学反应速率角度分析,在相同条件下,两种制取乙醛的方法哪种快?乙烯氧化法快.
(4)若将上述两种方法的反应条件,均增加“100个标准大气压”,原料转化率会再增大一些,但在实际生产中却不采用这样的方法,理由是因为两种方法在相同反应条件下,转化率已经很高,增大压强将消耗能量和增加设备预算,不经济.
(5)如果某工厂以乙烯为原料,通过3步可以制得聚氯乙烯,请写出合理的反应方程式(无机试剂和溶剂等任选,改过程中不发生取代反应)
 .
. 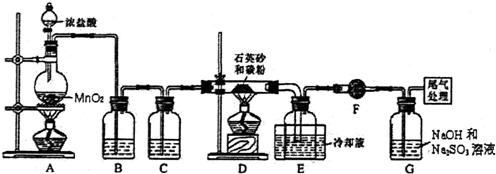
已知SiCl4的熔点为-70.0℃,沸点为57.7℃,且遇水易反应,
请回答下列问题:
(1)写出装置A中发生反应的离子方程式:MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2H2O+Cl2↑
(2)装置B中的试剂是饱和食盐水;装置C的作用为干燥氯气
(3)装置D的玻璃管中发生主要反应的化学方程式是SiO2+2C+2Cl2$\frac{\underline{\;\;△\;\;}}{\;}$SiCl4+2CO,装置F的作用为防止F右端的水蒸气进入E与四氯化硅反应,造成产物不纯.
(4)G中吸收气体一段时间后,吸收液中肯定存在OH-、Cl-和SO42-.为探究该吸收液中可能存在的其它酸根离子(忽略空气中CO2的影响),研究小组实验设计如下
【提出假设】假设1:只有SO32-:假设2:既无SO32-也无ClO-;假设3:只有ClO-:
【设计方案,进行试验】可供选择的实验试剂有:3mol/L H2SO4溶液、1mol/L NaOH溶液、品红溶液、0.01mol/L KMnO4溶液、淀粉-KI溶液.各取少量吸收液于a、b、c三支试管中,分别滴加3mol/L H2SO4酸化后,进行下列实验:
请完成如表:
| 序号 | 操作 | 可能出现的现象 | 结论 |
| ① | 向a试管中滴加几滴0.01mol/L的KMnO4 | 若溶液褪色 | 则假设1成立 |
| 若溶液不褪色 | 则假设2或3成立 | ||
| ② | 向b试管中滴加几滴品红 | 若溶液褪色 | 则假设1或3成立 |
| 若溶液不褪色 | 则假设2成立 | ||
| ③ | 向c试管中滴加几滴淀粉-KI溶液 | 则假设3成立 |
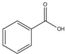 )为原料,制取苯甲酸甲酯.已知有关物质的沸点如下表:
)为原料,制取苯甲酸甲酯.已知有关物质的沸点如下表:| 物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
| 沸点/℃ | 64.7 | 249 | 199.6 |
在圆底烧瓶中加入12.2g苯甲酸(M=122g/mol)和20ml甲醇(密度约0.79g•mL-1 ),再小心加入3mL浓硫酸,混匀后,投入几粒碎瓷片,小心加热使反应完全,得苯甲酸甲酯粗产品.
(1)若反应产物水分子中有同位素18O,写出能表示反应前后18O位置的化学方程式C6H5CO18OH+CH3OH$?_{△}^{浓H_{2}SO_{4}}$C6H5COOCH3+H218O;浓硫酸的作用是:催化剂、吸水剂.
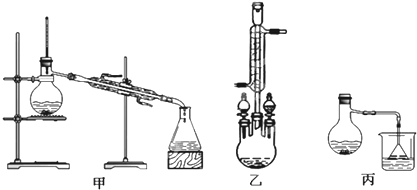
(2)甲、乙、丙三位同学分别设计了如下图三套实验室合成苯甲酸甲酯的装置(夹持仪器和加热仪器均已略去).根据有机物的沸点,最好采用乙装置(填“甲”或“乙”或“丙”).
Ⅱ.粗产品的精制
(3)苯甲酸甲酯粗产品中往往含有少量甲醇、硫酸、苯甲酸和水等,现拟用下列流程进行精制,请根据流程图写出操作方法的名称.操作Ⅰ分液 操作Ⅱ蒸馏.
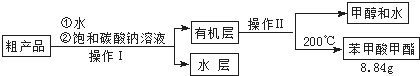
(4)能否用NaOH溶液代替饱和碳酸钠溶液?否(填“能”或“否”),并简述原因氢氧化钠是强碱,促进苯甲酸甲酯的水解,导致产品损失.
(5)通过计算,苯甲酸甲酯的产率是65%.
 实验室制备1,2二溴乙烷的反应原理如下:
实验室制备1,2二溴乙烷的反应原理如下:CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2═CH2+H2O
CH2═CH2+Br2-→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚.用少量溴和足量的乙醇制备1,2二溴乙烷的装置如下图所示:
有关数据列表如下:
| 乙醇 | 1,2二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是d;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入c,其目的是吸收反应中可能生成的酸性气体;(填正确选项前的字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的最简单方法是溴的颜色完全褪去;
(4)将1,2二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”)
(5)若产物中有少量未反应的Br2,最好用b洗涤除去;(填正确选项前的字母)
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(6)若产物中有少量副产物乙醚,可用蒸馏的方法除去;
(7)反应过程中应用冷水冷却装置D,其主要目的是冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞.
| A. |  | B. |  | C. |  | D. |  |

 某温度时,在一个5L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.试根据图中数据,填写下列空白:
某温度时,在一个5L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.试根据图中数据,填写下列空白: