题目内容
【题目】下列过程中,不属于化学变化的是( )
A.干电池供电过程
B.铁锅生锈
C.植物通过吸收太阳能进行光合作用
D.碘升华
【答案】D
【解析】
A.干电池供电过程发生电子的转移,有氧化还原反应发生,属于化学变化,故A不符合题意;
B.铁锅生锈,铁变成铁的化合物,属于化学变化,故B不符合题意;
C.植物的光合作用吸收二氧化碳产生氧气,属于化学变化,故C不符合题意;
D.碘升华,固态碘变成气态碘,没有新物质生成,属于物理变化,故D符合题意;
故答案为D。

 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案【题目】亚硝酰氯(NOCl,熔点:-64.5 ℃,沸点:-5.5 ℃)为红褐色液体或黄色气体,具有刺鼻恶臭味,遇水剧烈水解生成氮的两种氧化物与氯化氢,易溶于浓硫酸。常可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。其制备装置如图所示(其中III、IV中均为浓硫酸):
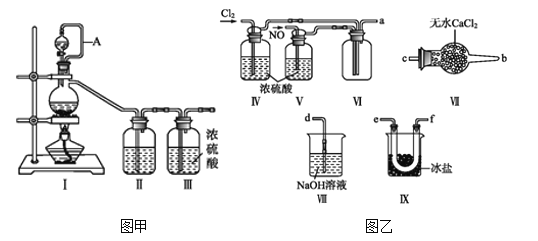
(1)用图甲中装置制备纯净干燥的原料气,补充下表中所缺少的药品。
装置Ⅰ | 装置Ⅱ | ||
烧瓶中 | 分液漏斗中 | ||
制备纯净Cl2 | MnO2 | 浓盐酸 | ①___ |
制备纯净NO | Cu | 稀硝酸 | ②___ |
(2)将制得的NO和Cl2通入图乙对应装置制备NOCl。
①装置连接顺序为a→________(按气流自左向右方向,用小写字母表示)。
②装置Ⅳ、Ⅴ除可进一步干燥NO、Cl2外,另一个作用是____________。
③有人认为可以将装置Ⅳ中浓硫酸合并到装置Ⅴ中,撤除装置Ⅳ,直接将NO、Cl2通入装置Ⅴ中,你同意此观点吗?________(填同意或不同意),原因是________________________________。
④实验开始的时候,先通入氯气,再通入NO,原因为________________。
(3)有人认为多余的氯气可以通过下列装置暂时储存后再利用,请选择可以用作氯气的储气的装置 ______;
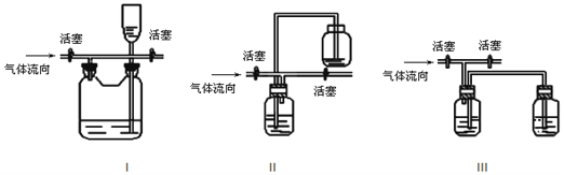
(4)装置Ⅶ吸收尾气时,NOCl发生反应的化学方程式为_______________________。
(5)有人认为装置Ⅶ中氢氧化钠溶液只能吸收氯气和NOCl,不能吸收NO,经过查阅资料发现用高锰酸钾溶液可以吸收NO气体,因此在装置Ⅶ氢氧化钠溶液中加入高锰酸钾,反应产生黑色沉淀,写出该反应的离子方程式:__________________________________。
(6)制得的NOCl中可能含有少量N2O4杂质,为测定产品纯度进行如下实验:称取1.6625 g样品溶于50.00 ml NaOH溶液中,加入几滴K2CrO4溶液作指示剂,用足量硝酸酸化的0.40mol/LAgNO3溶液滴定至产生砖红色沉淀,消耗AgNO3溶液50.00ml。
①样品的纯度为__________%(保留1位小数)
②已知常温下,Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=2×10-12,若在滴定终点时测得溶液中Cr2O42-的浓度是5.0×10-3 mol/L,此时溶液中Cl-浓度是_________。
【题目】实现 “节能减排” 和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源。目前工业上有一种方法是用CO2来生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化:
CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化:
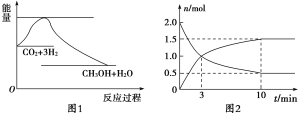
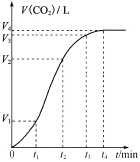
(1)为探究反应原理,现进行如下实验,在体积为2 L的密闭容器中,充入2 mol CO2和8 mol H2,一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
①从反应开始到平衡,CH3OH的平均反应速率v(CH3OH) =________;
②该反应的平衡常数表达式K=________。
(2)830 ℃,反应的平衡常数K=1,在恒容反应器中发生上述反应,按下表中的物质的量投入反应混合物,其中向正反应方向进行的有________(填“A”“B”“C”或“D”)。
物质 | A | B | C | D |
n(CO2) | 3 | 1 | 3 | 1 |
n(H2) | 2 | 2 | 4 | 2 |
n(CH3OH) | 1 | 2 | 3 | 0.5 |
n(H2O) | 4 | 2 | 3 | 2 |
(3)25 ℃,1.01×105Pa时,16g液态甲醇完全燃烧,当恢复到原状态时,放出363.3 kJ的热量,写出该反应的热化学方程式______________________________。
【题目】研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)CO可用于炼铁,
已知:Fe2O3(s)+ 3C(s)=2Fe(s)+ 3CO(g) ΔH 1=+489.0 kJ·mol-1
C(s) +CO2(g)=2CO(g) ΔH 2 =+172.5 kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为___________________________________。
(2)分离高炉煤气得到的CO与空气可设计成燃料电池(以KOH溶液为电解液)。写出该电池的负极反应式:____________________。
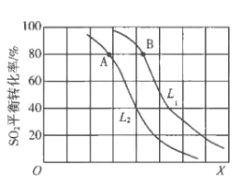
(3)CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化如图。①曲线I、Ⅱ对应的平衡常数大小关系为KⅠ_____KⅡ(填“>”或“=”或“<”)。
CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化如图。①曲线I、Ⅱ对应的平衡常数大小关系为KⅠ_____KⅡ(填“>”或“=”或“<”)。
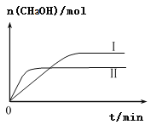
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
容 器 | 甲 | 乙 |
反应物投入量 | 1molCO2、3molH2 | a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为________。
③一定温度下,此反应在恒压容器中进行,能判断该反应达到化学平衡状态的依据是_____。
a.容器中压强不变 b.H2的体积分数不变 c.c(H2)=3c(CH3OH)
d.容器中密度不变 e.2个C=O断裂的同时有3个H-H断裂
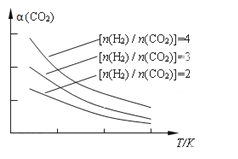
(4)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g) + 6H2(g)![]() CH3OCH3(g) + 3H2O(g)。已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2) / n(CO2)]的变化曲线如下图。若温度升高,则反应的平衡常数K将____(填“增大”、“减小”或“不变”。下同);若温度不变,提高投料比n(H2)/n(CO2),则K将__________;该反应△H_________0(填“>”、“<”或“=”)。
CH3OCH3(g) + 3H2O(g)。已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2) / n(CO2)]的变化曲线如下图。若温度升高,则反应的平衡常数K将____(填“增大”、“减小”或“不变”。下同);若温度不变,提高投料比n(H2)/n(CO2),则K将__________;该反应△H_________0(填“>”、“<”或“=”)。