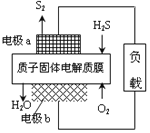
题目内容
【题目】生产硫酸的主要反应:2SO2(g)+O2(g)![]() 2SO3(g)△H<0。图中L(L1、L2)、X可分别代表压强或温度。下列说法正确的是
2SO3(g)△H<0。图中L(L1、L2)、X可分别代表压强或温度。下列说法正确的是
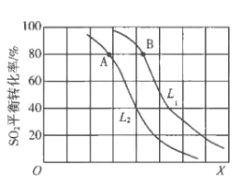
A. X代表压强
B. 推断L1>L2
C. A、B两点对应的平衡常数相同
D. 一定温度下,当混合气中n(SO2):n(O2):n(SO3)=2:1:2,则反应一定达到平衡
【答案】B
【解析】
生产硫酸的主要反应:2SO2(g)+O2(g)![]() 2SO3(g)△H<0,该反应的正反应是一个气体分子数目减少的放热反应,根据化学平衡移动原理可知,在其它条件不变时,随温度的升高,化学平衡逆向移动,二氧化硫的平衡转化率下降,故X代表温度;随着压强的增大,二氧化硫的平衡转化率增大,故图中L代表压强,且L1>L2,据此分析可得结论。
2SO3(g)△H<0,该反应的正反应是一个气体分子数目减少的放热反应,根据化学平衡移动原理可知,在其它条件不变时,随温度的升高,化学平衡逆向移动,二氧化硫的平衡转化率下降,故X代表温度;随着压强的增大,二氧化硫的平衡转化率增大,故图中L代表压强,且L1>L2,据此分析可得结论。
A.因该反应正反应是一个分子数目减少的反应,增大压强,平衡正向移动,二氧化硫的平衡转化率应增大,与图示变化不符,故A错误;
B.由上述分析可知,图中L代表压强,因该反应正反应是一个分子数目减少的反应,所以在其它条件相同时,压强越大,二氧化硫的转化率越大,则L1>L2,故B正确;
C.由上述分析可知,X代表温度,则A、B两点的温度不同,化学平衡常数不同,故C错误;
D.一定温度下,当混合气中n(SO2):n(O2):n(SO3)=2:1:2时,反应混合物中各组份的浓度不一定保持不变,不一定是平衡状态,故D错误;
答案选B。

【题目】某化学课外活动小组为了验证元素化学性质递变规律,进行如下实验探究。
Ⅰ.探究1:验证同周期X、Y、Z三种元素金属性递变规律
实验内容 | 实验现象 |
1、各取1.0g金属X和金属Z,分别加入到5mL水中 | 金属X与水反应比金属Z剧烈 |
2、各取1.0g的金属Z和金属Y(形状相同),分别加入到5mL1.0mol/L盐酸中。 | 金属Z与盐酸反应比金属Y剧烈 |
通过实验验证三种元素金属性由强到弱是_____,则下列判断正确的是(__________)
A.原子序数:Y>Z>X B.原子的最外层电子数X>Y>Z
C.原子半径:Y>Z>X D.Y的最高价氧化物对应水化物的碱性最强
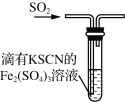
Ⅱ.探究2:验证氯元素的非金属性比硫元素的非金属性强,设计如下实验:
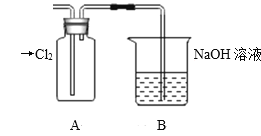
(1)装置A中盛放的试剂是_______(填选项),化学反应方程式是_________。
A.Na2SO3溶液 B.Na2S溶液 C.Na2SO4溶液
(2)下列不能用于验证氯元素比硫元素非金属性强的依据为______(填选项)。
A.HCl比H2S稳定
B.HClO氧化性比H2SO4强
C.HClO4酸性比H2SO4强
D.铁与Cl2反应生成FeCl3,而硫与铁反应生成FeS
(3)若要验证非金属性:Cl>I,装置A中加入淀粉碘化钾混合溶液,观察到装置A中溶液_______的现象,即可证明。用原子结构理论解释非金属性Cl>I的原因:同主族元素从上到下,________________。
【题目】试回答下列各题:
(1)如图1所示是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式: ______________________________。
(2)化学反应的焓变与反应物和生成物的键能有关。
①已知:H2(g)+Cl2(g)===2HCl(g) ΔH=-185 kJ·mol-1
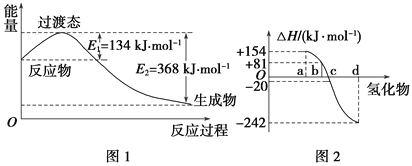
请填空:
共价键 | H—H | Cl—Cl | H—Cl |
键能/(kJ·mol-1) | 436 | 247 | ________ |
②图2中表示氧族元素中氧、硫、硒、碲生成氢化物时的焓变数据,根据焓变数据可确定a、b、c、d分别代表哪种元素,试写出硒化氢在热力学标准状态下,发生分解反应的热化学方程式: ___________________________________。