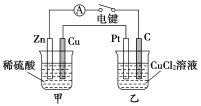
题目内容
【题目】研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)CO可用于炼铁,
已知:Fe2O3(s)+ 3C(s)=2Fe(s)+ 3CO(g) ΔH 1=+489.0 kJ·mol-1
C(s) +CO2(g)=2CO(g) ΔH 2 =+172.5 kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为___________________________________。
(2)分离高炉煤气得到的CO与空气可设计成燃料电池(以KOH溶液为电解液)。写出该电池的负极反应式:____________________。
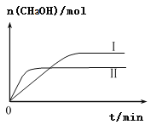
(3)CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化如图。①曲线I、Ⅱ对应的平衡常数大小关系为KⅠ_____KⅡ(填“>”或“=”或“<”)。
CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化如图。①曲线I、Ⅱ对应的平衡常数大小关系为KⅠ_____KⅡ(填“>”或“=”或“<”)。
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
容 器 | 甲 | 乙 |
反应物投入量 | 1molCO2、3molH2 | a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为________。
③一定温度下,此反应在恒压容器中进行,能判断该反应达到化学平衡状态的依据是_____。
a.容器中压强不变 b.H2的体积分数不变 c.c(H2)=3c(CH3OH)
d.容器中密度不变 e.2个C=O断裂的同时有3个H-H断裂
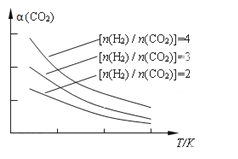
(4)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g) + 6H2(g)![]() CH3OCH3(g) + 3H2O(g)。已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2) / n(CO2)]的变化曲线如下图。若温度升高,则反应的平衡常数K将____(填“增大”、“减小”或“不变”。下同);若温度不变,提高投料比n(H2)/n(CO2),则K将__________;该反应△H_________0(填“>”、“<”或“=”)。
CH3OCH3(g) + 3H2O(g)。已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2) / n(CO2)]的变化曲线如下图。若温度升高,则反应的平衡常数K将____(填“增大”、“减小”或“不变”。下同);若温度不变,提高投料比n(H2)/n(CO2),则K将__________;该反应△H_________0(填“>”、“<”或“=”)。
【答案】Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g);ΔH=-28.5 kJ·mol-1 CO-2e-+4OH-=CO32-+2H2O > 1≥c>0.4 bd 减小 不变 <
【解析】
(1)根据盖斯定律对已知的两个热化学方程式进行加合运算;
(2)分析CO燃烧反应方程式2CO+O2=2CO2,分析元素化合价变化确定负极原料及电子转移数目,电解质显强碱性,CO2、H+不能大量存在;
(3) ①一定温度下,可逆反应达到平衡状态时生成物浓度幂之积与反应物浓度幂之积的比值是一个常数,称之为化学平衡常数,本题图像是生成物CH3OH的物质的量与时间函数关系,“先拐先平”的原则,生成物浓度越大,则反应物浓度越小,平衡常数就越大。②因为“要使平衡后乙与甲中相同组分的体积分数相等”,所以甲、乙互为“等同平衡”,平衡时各组分物质的量分别对应相等,利用“三段式”确定甲、乙容器中平衡时CH3OH物质的量,若使起始时维持化学反应向逆反应方向进行,则CH3OH初始物质的量不能低于平衡时的CH3OH物质的量,另外,只有反应完全从生成物开始,c才能取最大值。③判断化学平衡状态的标志有两条依据:一是根据正、逆反应速率相等;二是某一物理量不变时,“变量不变”。
(4) 根据平衡常数表达式![]() 分析反应物浓度与生成物浓度的相对变化即可解答。由图像分析温度影响平衡移动的方向,再根据勒夏特列原理分析该反应热△H的正负。
分析反应物浓度与生成物浓度的相对变化即可解答。由图像分析温度影响平衡移动的方向,再根据勒夏特列原理分析该反应热△H的正负。
(1)将已知的两个热化学方程式编号:①Fe2O3(s)+3C(s)=2Fe(s)+3CO(g); ΔH1=+489.0 kJ·mol-1,②C(s)+CO2(g)=2CO(g);ΔH2=+172.5kJ·mol-1。将①②×3得Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g);ΔH=ΔH13ΔH2=489.0 kJ·mol-13×172.5 kJ·mol-1=-28.5 kJ·mol-1。所以CO还原Fe2O3(s)的热化学方程式为Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g);ΔH=-28.5 kJ·mol-1。
(2)该燃料电池总反应为2CO+O2=2CO2,CO在反应中失去电子,所以通入CO的一极是负极,因为电解质溶液是KOH,所以CO2转化成CO32-,根据碳元素化合价由+2升高到+4,1molCO失去2mol电子,负极反应式为:CO-2e-+4OH-=CO32-+2H2O
(3)①图像I、II曲线平行于时间轴对应的状态是平衡状态,平衡状态时CH3OH物质的量曲线I比曲线II多,因容器体积一定,所以平衡时曲线I的生成物浓度比曲线II的生成物浓度高,根据平衡常数表达式![]() ,可知曲线I的平衡常数比曲线II要大,所以KⅠ>KⅡ。
,可知曲线I的平衡常数比曲线II要大,所以KⅠ>KⅡ。
②利用“三段式”先求出甲容器平衡时各组分物质的量。设甲容器平衡时CH3OH的物质的量为x。
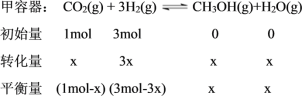
恒温恒容下,![]() ,则有
,则有![]() ,解得x=0.4mol。甲容器平衡时各组分物质的量分别为CO2为0.6mol、H2为1.8mol、CH3OH为0.4mol、H2O(g)为0.4mol。
,解得x=0.4mol。甲容器平衡时各组分物质的量分别为CO2为0.6mol、H2为1.8mol、CH3OH为0.4mol、H2O(g)为0.4mol。
因为“要使平衡后乙与甲中相同组分的体积分数相等”,甲、乙互为“等同平衡”,所以达到平衡时甲、乙容器中各组分物质的量分别对应相等。要使反应开始时逆向进行则有下列相关量:
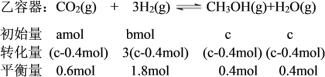
若使起始时维持化学反应向逆反应方向进行,初始投入的CH3OH和H2O(g)的物质的量不能低于它们平衡时的物质的量,即c>0.4,
初始时全部由生成物投料c取最大值,即a、b为0, (c-0.4mol)=0.6mol,解得c=1,所以c的范围是1≥c>0.4。
③a.因为反应在恒压条件下进行,容器中压强一直未变化,所以容器中压强不变不能作为反应达到平衡状态的依据,a项错误;
b.反应过程中H2的体积分数一直在变化,所以H2的体积分数不变能判断该反应已达平衡状态,b项正确;
c. c(H2)=3c(CH3OH),但反应过程中其数值可能在变也可能不变,所以c(H2)=3c(CH3OH)不能判断该反应已达平衡状态,c项错误;
d.根据质量守恒可知反应混合物总质量[m(总)]不变,但反应过程中气体的体积(V)一直在变化,根据密度![]() 可知容器中气体密度一直在变化,所以容器中气体密度不变可判断该反应达到平衡状态,d项正确;
可知容器中气体密度一直在变化,所以容器中气体密度不变可判断该反应达到平衡状态,d项正确;
e.CO2结构是O=C=O,H2的结构是H—H,单位时间内“2个C=O断裂”是用CO2表示的正反应速率,单位时间内“3个H—H断裂”是用H2表示的正反应速率,无法确定正、逆反应速率是否相等,所以2个C=O断裂的同时有3个H-H断裂不能判断该反应达到平衡状态,e项错误;答案选bd。
(4)由图像知在投料比不变时CO2的平衡转化率随温度的升高而减小,即生成物浓度越来越小,反应物浓度越来越大,根据平衡常数表达式![]() 推知平衡常数值越来越小,所以升高温度,反应的平衡常数K将减小。因为平衡常数只受温度的影响,与浓度无关,所以温度不变时,提高投料比,平衡常数K不变。由图像知随温度升高CO2的平衡转化率减小,即平衡向逆反应方向移动,根据勒夏特列原理,逆反应方向是吸热反应,则正反应为放热反应,即该反应△H<0。
推知平衡常数值越来越小,所以升高温度,反应的平衡常数K将减小。因为平衡常数只受温度的影响,与浓度无关,所以温度不变时,提高投料比,平衡常数K不变。由图像知随温度升高CO2的平衡转化率减小,即平衡向逆反应方向移动,根据勒夏特列原理,逆反应方向是吸热反应,则正反应为放热反应,即该反应△H<0。

 阅读快车系列答案
阅读快车系列答案【题目】室温下,将一元酸HA溶液和KOH溶液等体积混合,实验数据如下表:
实验编号 | 起始浓度/(mol·L-1) | 反应后溶 液的pH | |
[HA] | [KOH] | ||
① | 0.1 | 0.1 | 9 |
② | x | 0.2 | 7 |
下列判断不正确的是( )
A. 实验①反应后的溶液中:[K+]>[A-]>[OH-]>[H+]
B. 实验①反应后的溶液中:[OH-]=[K+]-[A-]=![]() mol·L-1
mol·L-1
C. 实验②反应后的溶液中:[A-]+[HA]>0.1 mol·L-1
D. 实验②反应后的溶液中:[K+]=[A-]>[OH-]=[H+]
【题目】试回答下列各题:
(1)如图1所示是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式: ______________________________。
(2)化学反应的焓变与反应物和生成物的键能有关。
①已知:H2(g)+Cl2(g)===2HCl(g) ΔH=-185 kJ·mol-1
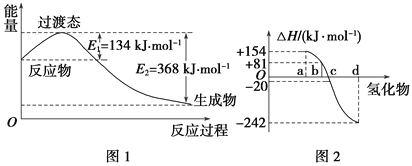
请填空:
共价键 | H—H | Cl—Cl | H—Cl |
键能/(kJ·mol-1) | 436 | 247 | ________ |
②图2中表示氧族元素中氧、硫、硒、碲生成氢化物时的焓变数据,根据焓变数据可确定a、b、c、d分别代表哪种元素,试写出硒化氢在热力学标准状态下,发生分解反应的热化学方程式: ___________________________________。