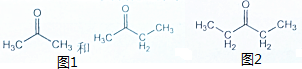
题目内容
10.下列各组中的离子,能在溶液中大量共存的是( )| A. | H+、Mg2+、OH-、Cl- | B. | H+、Na+、SO42-、CO32- | ||
| C. | K+、Ag+、Cl-、NO3- | D. | Ca2+、K+、Cl-、NO3- |
分析 A.氢离子、镁离子都与氢氧根离子反应;
B.氢离子与碳酸根离子发生反应;
C.银离子与氯离子反应生成氯化银沉淀;
D.四种离子之间不发生反应,能够大量共存.
解答 解:A.H+、Mg2+都与OH-发生反应,在溶液中不能大量共存,故A错误;
B.H+离子与CO32-反应,在溶液中不能大量共存,故B错误;
C.Ag+、Cl-之间反应生成AgCl沉淀,在溶液中不能大量共存,故C错误;
D.Ca2+、K+、Cl-、NO3-离子之间不反应,在溶液中能够大量共存,故D正确;
故选D.
点评 本题考查离子共存,属于中等难度的试题,注意掌握离子反应发生条件,明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间,能发生络合反应的离子之间(如 Fe3+和 SCN-)等;试题侧重对学生基础知识的训练和检验,有利于培养学生灵活运用基础知识的能力.

练习册系列答案
相关题目
18.在环境检测中常用检气管法来测定空气中S02的含量,原理是S02与KIO3发生反应,用一种有机物作指示剂,其可能反应如下(未配平):①KIO3+SO2+H2O→I2+H2SO4+KHSO4 ②KIO3+SO2+H2O→KI+H2SO4,则下列说法正确的是( )
| A. | 检气管法是按照反应①原理设计的 | |
| B. | 检气管法是按照反应②原理设计的 | |
| C. | 反应①②均可以设计成检气管法,但考虑到相同量KIO3①消耗SO2少,所以检气管法是按①设计的 | |
| D. | 反应①②均可以设计成检气管法,但考虑到相同量KIO3②消耗SO2多,所以检气管法是按②设计的 |
5.下列各组混合物中,可用过滤法进行分离的是( )
| A. | 碘和四氯化碳 | B. | AgCl和水 | ||
| C. | 一氧化碳和二氧化碳 | D. | 铁粉和铜粉 |
15. 如图是某学生设计的一个原电池,若要装置中电流计发生偏转,则M、N两极的组成材料及液体X分别是( )
如图是某学生设计的一个原电池,若要装置中电流计发生偏转,则M、N两极的组成材料及液体X分别是( )
 如图是某学生设计的一个原电池,若要装置中电流计发生偏转,则M、N两极的组成材料及液体X分别是( )
如图是某学生设计的一个原电池,若要装置中电流计发生偏转,则M、N两极的组成材料及液体X分别是( )| A. | Cu、石墨、NaOH溶液 | B. | 石墨、石墨、水 | ||
| C. | Cu、Fe、酒精 | D. | Zn、Cu、稀H2SO4溶液 |
5.下列实验方法或试剂保存方法正确的是( )
| A. | 碘中混有沙子,不可以用升华方法提纯 | |
| B. | 金属钠通常保存在煤油里,不能保存在四氯化碳中 | |
| C. | 用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,又把过量的试剂倒回试剂瓶中 | |
| D. | 把NaOH固体直接放入容量瓶中,加水到刻度线就配成一定物质的量浓度的NaOH溶液 |
6.下列叙述中,不正确的是( )
| A. | 难溶物Ba3(PO4)2的溶度积表达式为Ksp=c(Ba2+)3•c(PO43-)2 | |
| B. | aA(g)+bB(g)?cC(g),若将容器体积增至原来2倍,C浓度降至原来的0.5倍,则a+b=c | |
| C. | 对于2SO2(g)+O2(g)?2SO3(g)的平衡体系,在温度、容器体积保持不变时充入少量SO3,则正反应速率减小、逆反应速率增大,平衡向逆反应方向移动 | |
| D. | 对于N2(g)+3H2(g)?2NH3(g)△H的平衡体系,仅将所有物质浓度加倍,平衡将向正反应方向移动,但△H不变 |