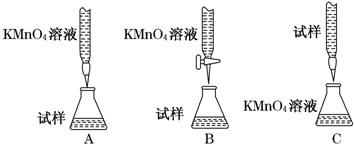
题目内容
9.设阿伏加德罗常数的数值为NA,下列说法正确的是( )| A. | 1molCl2与1molFe反应,转移的电子数为3NA | |
| B. | 含0.2 mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1 NA | |
| C. | 在标准状况下,Cl2和H2的混合气22.4升,光照后原子总数为2NA | |
| D. | 0.1mol•L-1的FeCl3溶液中含有0.1NA个Fe3+ |
分析 A、1mol氯气和1mol铁反应,铁过量,应根据氯气的额量来分析转移电子的个数;
B、铜只能与浓硫酸反应,与稀硫酸不反应;
C、反应过程中满足原子个数守恒;
D、溶液体积不明确.
解答 解:A、1mol氯气和1mol铁反应,铁过量,应根据氯气的量来分析转移电子的个数,而反应后氯元素的化合价为-1价,故1mol氯气转移2mol电子,个数为2NA个,故A错误;
B、铜只能与浓硫酸反应,与稀硫酸不反应,故当浓硫酸变稀后反应即停止,则2mol硫酸不能完全反应,生成SO2的分子数小于0.1 NA,故B错误;
C、标准状况下,Cl2和H2的混合气22.4L,混合气体的物质的量为1mol,而氢气和氯气均为双原子分子,故混合气体中含2mol原子,而反应过程中满足原子个数守恒,反应后原子个数不变,故反应后的气体中的原子个数仍为2NA个,故C正确;
D、溶液体积不明确,故溶液中的三价铁离子的个数无法计算,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握公式的运用和物质的结构是解题关键,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
19.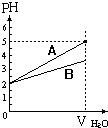 pH值等于2的两种酸溶液A和B,分别加水稀释1000倍,其pH值与所加水的体积变化趋势示意图如图所示,则下列结论正确的是:( )
pH值等于2的两种酸溶液A和B,分别加水稀释1000倍,其pH值与所加水的体积变化趋势示意图如图所示,则下列结论正确的是:( )
 pH值等于2的两种酸溶液A和B,分别加水稀释1000倍,其pH值与所加水的体积变化趋势示意图如图所示,则下列结论正确的是:( )
pH值等于2的两种酸溶液A和B,分别加水稀释1000倍,其pH值与所加水的体积变化趋势示意图如图所示,则下列结论正确的是:( )| A. | 等体积pH=2的两种酸中和NaOH的能力酸A比酸B强 | |
| B. | A为弱酸,B为强酸 | |
| C. | 酸B的摩尔浓度比酸A大 | |
| D. | A比B易电离 |
17.下列溶液中有关微粒的物质的量浓度关系正确的是( )
| A. | 在0.1 mol•L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| B. | 常温下,一定量的醋酸中逐滴滴加氢氧化钠溶液发生中和反应当溶液中c(Na+)>c(CH3COO-)>c(OH-)>c(H+)时,醋酸一定过量 | |
| C. | 在0.1 mol•L-1Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3) | |
| D. | 在0.1mol•L-1NH4HSO4溶液中:c(H+)>c( SO42-)>c(NH4+)>c(OH-) |
4.等质量的下列有机物完全燃烧,消耗O2最多的是( )
| A. | CH4 | B. | CH2=CH2 | C. |  | D. | CH3CH2OH |
14.下列各组离子,在水溶液中不能大量共存的是( )
| A. | H+、K+、Cl-、NO3- | B. | K+、A13+、Cl-、AlO2- | ||
| C. | Na+、K+、CO32-、NO3- | D. | A13+、Cu2+、SO42-、I- |
18.原电池的电极名称不仅与电极的性质有关,也与电解质溶液有关,下列说法中不正确的是( )
| A. | 有Al、Cu、稀H2SO4组成原电池,其负极反应式为:Al-3e-═Al3+ | |
| B. | Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3e-═Al3+ | |
| C. | 由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Cu-2e-═Cu2+ | |
| D. | 由Al、Cu、浓硝酸组成原电池,其负极反应式为:Cu-2e-═Cu2+ |
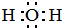 ,HCl中的化学键类型是共价键.
,HCl中的化学键类型是共价键.