题目内容
17.下列溶液中有关微粒的物质的量浓度关系正确的是( )| A. | 在0.1 mol•L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| B. | 常温下,一定量的醋酸中逐滴滴加氢氧化钠溶液发生中和反应当溶液中c(Na+)>c(CH3COO-)>c(OH-)>c(H+)时,醋酸一定过量 | |
| C. | 在0.1 mol•L-1Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3) | |
| D. | 在0.1mol•L-1NH4HSO4溶液中:c(H+)>c( SO42-)>c(NH4+)>c(OH-) |
分析 A.碳酸氢钠溶液中,碳酸氢根离子的电离程度大于其水解程度,则:c(H2CO3)>c(CO32-);
B.当醋酸与强氧化钠恰好反应生成醋酸钠,醋酸根离子水解,溶液呈碱性,也满足该关系;
C.根据碳酸钠溶液中的质子守恒判断;
D.硫酸氢铵完全电离出氢离子、铵根离子和硫酸根离子,氢离子来自水的电离和硫酸氢铵的电离,则c(H+)>c( SO42-),铵根离子部分水解,则铵根离子浓度减小.
解答 解:A.在0.1 mol•L-1NaHCO3溶液中,碳酸氢根离子的电离程度大于其水解程度,则:c(H2CO3)>c(CO32-),溶液中正确的离子浓度大小为:c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-),故A错误;
B.常温下,一定量的醋酸中逐滴滴加氢氧化钠溶液发生中和反应,当溶液中c(Na+)>c(CH3COO-)>c(OH-)>c(H+)时,溶质可能为醋酸钠,即醋酸与强氧化钠恰好反应,醋酸不一定过量,故B错误;
C.在0.1 mol•L-1Na2CO3溶液中,根据质子守恒c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)可得:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3),故C正确;
D.0.1mol•L-1NH4HSO4溶液中,氢离子来自水的电离和硫酸氢铵的电离,则c(H+)>c( SO42-),铵根离子部分水解,则铵根离子浓度减小,则溶液中离子浓度大小为:c(H+)>c( SO42-)>c(NH4+)>c(OH-),故D正确;
故选CD.
点评 本题考查了离子浓度大小比较,题目难度中等,注意掌握盐的水解原理及其影响,明确电荷守恒、物料守恒、质子守恒及盐的水解原理在离子浓度大小中的应用方法.

练习册系列答案
相关题目
7.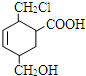 某有机物的结构简式如图所示,它在一定条件下可能发生的反应是( )
某有机物的结构简式如图所示,它在一定条件下可能发生的反应是( )
①加成反应 ②水解反应 ③酯化反应 ④氧化反应 ⑤还原反应⑥消去反应.
 某有机物的结构简式如图所示,它在一定条件下可能发生的反应是( )
某有机物的结构简式如图所示,它在一定条件下可能发生的反应是( )①加成反应 ②水解反应 ③酯化反应 ④氧化反应 ⑤还原反应⑥消去反应.
| A. | ①③④⑤⑥ | B. | ①②③④⑤ | C. | ①③⑤⑥ | D. | 全部 |
8.目前人类已发现几千万种物质,对物质进行分类,有利于我们的学习.下列关于物质的类别中,不正确的是(括号内为类别)( )
| A. | Al2O3(两性氧化物) | B. | H2SO4(含氧酸) | C. | CH3COOH(烃) | D. | 食醋(混合物) |
2.分子式为CH2Cl2的有机物同分异构体共有(不考虑立体异构)( )
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
9.设阿伏加德罗常数的数值为NA,下列说法正确的是( )
| A. | 1molCl2与1molFe反应,转移的电子数为3NA | |
| B. | 含0.2 mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1 NA | |
| C. | 在标准状况下,Cl2和H2的混合气22.4升,光照后原子总数为2NA | |
| D. | 0.1mol•L-1的FeCl3溶液中含有0.1NA个Fe3+ |
6.在1L0.1mol•L-1的NaHCO3溶液中,下列关系式正确( )
| A. | c(Na+)>c(HCO3-)>c(CO32-)>c(H+)>c(OH-) | B. | c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) | ||
| C. | c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | D. | c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) |
7.下列关于16O与18O的说法正确的是( )
| A. | 16O与18O互为同位素 | B. | 16O与18O具有不同的电子数 | ||
| C. | 16O与18O互为同素异形体 | D. | 16O与18O化学性质不同 |
 (1)2003年夏,全球化学家投票评选了化学史上十项最美的实验,1848年巴斯德用手工在光学显微镜下把左型酒石酸盐晶体和右型酒石酸盐晶体分开的实验被选为十项之首.请回答下列问题:
(1)2003年夏,全球化学家投票评选了化学史上十项最美的实验,1848年巴斯德用手工在光学显微镜下把左型酒石酸盐晶体和右型酒石酸盐晶体分开的实验被选为十项之首.请回答下列问题: .
.