题目内容
20.化学反应的过程就是化学键的断裂和形成的过程.已知:①将lmolO2拆成原子后,需要能量498kJ.
②Cl形成lmolCl2时,放出能量243kJ.
(1)H2O的电子式是
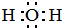 ,HCl中的化学键类型是共价键.
,HCl中的化学键类型是共价键.(2)对于一定条件下的反应:4HCl+O2═2Cl2+2H2O,4molHCl被氧化时放出115.6kJ热量.则断开lmolH-O键与断开lmolH-Cl键所需能量相差约为32kJ.水中H-O键HCl中H-Cl相比,更稳定的化学键是H-O.
分析 (1)根据H2O为共价化合物书写电子式,HCl为非金属之间形成的共价键;
(2)反应热△H=反应物总键能-生成物的总键能,据此计算H-O键与H-Cl键的键能差,进而计算断开1mol H-O键与断开1mol H-Cl键所需能量差.
解答 解:(1)因为H2O为共价化合物,则H2O的电子式为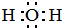 ,HCl为非金属之间形成的共价键,故答案为:
,HCl为非金属之间形成的共价键,故答案为: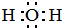 ;共价键;
;共价键;
(2)E(H-O)、E(H-Cl)分别表示H-O键能、H-Cl键能,
反应中,4mol HCl被氧化,放出115.6kJ的热量,反应热△H=反应物总键能-生成物的总键能,故:
4×E(H-Cl)+498kJ/mol-[2×243kJ/mol+4×E(H-O)]=-115.6kJ/mol,
整理得,4E(H-Cl)-4E(H-O)=-127.6kJ/mol,即E(H-O)-E(HCl)=31.9kJ/mol,故断开1mol H-O键与断开1mol H-Cl键所需能量相差约为31.9kJ/mol×1mol=31.9kJ≈32kJ,更稳定的化学键是H-O;故答案为:32kJ;H-O.
点评 本题考查了焓变、焓变等于反应物的键能和减去生成物的键能和,题目难度中等.

练习册系列答案
相关题目
10.从海水(含氯化镁)中提取镁,涉及如下步骤:
①将沉淀物与盐酸反应,结晶、过滤 ②在HCl气体氛围中干燥产物
③过滤、洗涤沉淀物 ④将得到的产物熔融电解得到镁
⑤把贝壳制成石灰乳[Ca(OH)2],在引入的海水中加入石灰乳,沉降.
下列说法正确的是( )
①将沉淀物与盐酸反应,结晶、过滤 ②在HCl气体氛围中干燥产物
③过滤、洗涤沉淀物 ④将得到的产物熔融电解得到镁
⑤把贝壳制成石灰乳[Ca(OH)2],在引入的海水中加入石灰乳,沉降.
下列说法正确的是( )
| A. | 正确操作步骤的顺序是⑤②③①④ | |
| B. | 步骤④电解时阴极产生氯气 | |
| C. | 直接在空气中将MgCl2溶液蒸干可得到Mg(OH)2 | |
| D. | 此法提取镁的过程中涉及置换、分解、化合和复分解反应 |
11.镁条在下列那种气体中无法燃烧( )
| A. | O2 | B. | N2 | C. | Ar | D. | CO2 |
8.目前人类已发现几千万种物质,对物质进行分类,有利于我们的学习.下列关于物质的类别中,不正确的是(括号内为类别)( )
| A. | Al2O3(两性氧化物) | B. | H2SO4(含氧酸) | C. | CH3COOH(烃) | D. | 食醋(混合物) |
15.下列物质易溶于水的是( )
| A. | 葡萄糖 | B. | 油脂 | C. | 苯 | D. | 乙烯 |
9.设阿伏加德罗常数的数值为NA,下列说法正确的是( )
| A. | 1molCl2与1molFe反应,转移的电子数为3NA | |
| B. | 含0.2 mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1 NA | |
| C. | 在标准状况下,Cl2和H2的混合气22.4升,光照后原子总数为2NA | |
| D. | 0.1mol•L-1的FeCl3溶液中含有0.1NA个Fe3+ |
10.下列含有非极性键的离子化合物是( )
| A. | 乙醇 | B. | 氯化铵 | C. | 过氧化钠 | D. | 氯化镁 |
 (1)2003年夏,全球化学家投票评选了化学史上十项最美的实验,1848年巴斯德用手工在光学显微镜下把左型酒石酸盐晶体和右型酒石酸盐晶体分开的实验被选为十项之首.请回答下列问题:
(1)2003年夏,全球化学家投票评选了化学史上十项最美的实验,1848年巴斯德用手工在光学显微镜下把左型酒石酸盐晶体和右型酒石酸盐晶体分开的实验被选为十项之首.请回答下列问题: .
.