��Ŀ����
����Ŀ����֪��N2O4(g)![]() 2NO2(g) ��H=��52��70kJ��mol-1
2NO2(g) ��H=��52��70kJ��mol-1
��1���ں��¡����ݵ��ܱ������У�����������Ӧʱ�����������У���˵���÷�Ӧ�Ѵﵽƽ�����___��
A��v��(N2O4)=2v��(NO2)
B�������������ƽ����Է�����������ʱ����仯
C��������������ܶȲ���ʱ����仯
D������������ķ�����������ʱ����仯
��2��t�������£��ڹ̶��ݻ�Ϊ2L���ܱ������г���0��054molN2O4��30���ﵽƽ�⣬��������к�n(NO2)=0��06mol����t��ʱ��ӦN2O4(g)![]() 2NO2(g)��ƽ�ⳣ��K=___�����������ڼ���ͨ������N2O4����ƽ��___�ƶ�(����������Ӧ�������������淴Ӧ��������������)���ٴδﵽƽ���NO2���������__ԭƽ��ʱNO2���������(��������������С��������������)��
2NO2(g)��ƽ�ⳣ��K=___�����������ڼ���ͨ������N2O4����ƽ��___�ƶ�(����������Ӧ�������������淴Ӧ��������������)���ٴδﵽƽ���NO2���������__ԭƽ��ʱNO2���������(��������������С��������������)��
��3��ȡ��ȷ�NO2���ֱ���뵽�¶Ȳ�ͬ���ݻ���ͬ�ĺ����ܱ������У�������Ӧ��2NO2(g)![]() N2O4(g)����Ӧ��ͬʱ��ֱ�ⶨ��ϵ��NO2�İٷֺ���(NO2%)����������ٷֺ����淴Ӧ�¶�(T)�仯�Ĺ�ϵͼ������ʾ��ͼ�У�������ʵ�����������___��
N2O4(g)����Ӧ��ͬʱ��ֱ�ⶨ��ϵ��NO2�İٷֺ���(NO2%)����������ٷֺ����淴Ӧ�¶�(T)�仯�Ĺ�ϵͼ������ʾ��ͼ�У�������ʵ�����������___��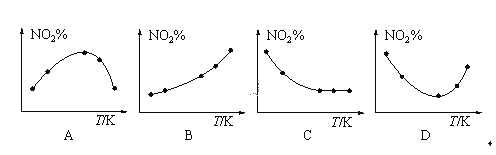
���𰸡�BD 0��075mol��L-1 ������Ӧ���� С�� BD
��������
��1������ƽ���־�жϣ�
��2��K= ������Ӧ���Ũ��ƽ�������ƶ���
������Ӧ���Ũ��ƽ�������ƶ���
��3���÷�Ӧ�������С�ġ����ȵĿ��淴Ӧ�����Է�Ӧ�ﵽƽ��������¶ȣ�ƽ�����淴Ӧ�����ƶ���NO2�ĺ�������
��1��A����Ӧ�ﵽƽ��״̬�����淴Ӧ���ʱȵ���ϵ���ȣ�����2v��(N2O4)=v��(NO2)ʱ����Ӧ��ƽ�⣬�ʲ�ѡA��
B�� ��Ӧǰ���������ʵ�����ͬ������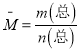 ��ƽ����Է��������DZ������������������ƽ����Է�����������ʱ����仯����Ӧһ���ﵽƽ��״̬����ѡB��
��ƽ����Է��������DZ������������������ƽ����Է�����������ʱ����仯����Ӧһ���ﵽƽ��״̬����ѡB��
C�� ����![]() ����Ӧ�ں��ݵ��ܱ������н��У��ܶ��Ǻ�����������������ܶȲ���ʱ����仯����Ӧ��һ���ﵽƽ��״̬���ʲ�ѡC��
����Ӧ�ں��ݵ��ܱ������н��У��ܶ��Ǻ�����������������ܶȲ���ʱ����仯����Ӧ��һ���ﵽƽ��״̬���ʲ�ѡC��
D�� ��Ӧǰ���������ʵ�����ͬ���������DZ���������������ķ�����������ʱ����仯��һ���ﵽƽ��״̬����ѡD��
��ѡBD��
��2��

K=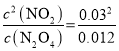 =0��075mol��L-1������Ӧ���Ũ��ƽ�������ƶ������������ڼ���ͨ������N2O4����ƽ��������Ӧ�����ƶ����ٴδﵽƽ�⣬�൱�ڼ�ѹ��N2O4ת���ʼ�С��NO2���������С��ԭƽ��ʱNO2�����������
=0��075mol��L-1������Ӧ���Ũ��ƽ�������ƶ������������ڼ���ͨ������N2O4����ƽ��������Ӧ�����ƶ����ٴδﵽƽ�⣬�൱�ڼ�ѹ��N2O4ת���ʼ�С��NO2���������С��ԭƽ��ʱNO2�����������
��3��A���÷�Ӧ���ȣ������¶ȣ�ƽ�����淴Ӧ�����ƶ���NO2�ĺ�������A����
B����5�������ڷ�Ӧ��ͬʱ���£����Ѵﵽƽ�⣬��Ϊ�÷�Ӧ�Ƿ��ȷ�Ӧ���¶�Խ�ߣ�ƽ�����淴Ӧ�����ƶ���NO2�İٷֺ������¶����߶����ߣ���B��ȷ��
C���÷�Ӧ���ȣ������¶ȣ�ƽ�����淴Ӧ�����ƶ���NO2�ĺ�������C����
D����5����������δ�ﵽƽ��״̬�ģ���ô�¶�Խ�ߣ���Ӧ����Խ������¶ȸߵ�NO2ת���ÿ죬����NO2�İٷֺ����ٵ��������Dͼ��ת�۵�Ϊƽ��״̬��ת�۵����Ϊδƽ��״̬���Ҳ�Ϊƽ��״̬�������¶ȣ�ƽ�����淴Ӧ�����ƶ�����D��ȷ��
��ѡBD��