题目内容
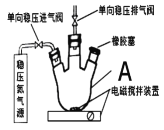
【题目】水中溶氧量(DO)是衡量水体自净能力的一个指标,通常用每升水中溶解氧分子的质量表示,单位mg·L-1,我国《地表水环境质量标准》规定,生活饮用水源的DO不能低于5mg·L-1。某化学小组同学设计了下列装置(夹持装置略),测定某河水的DO。
Ⅰ.测定原理:
碱性条件下,O2将Mn2+氧化为MnO(OH)2:①2Mn2++O2+4OH-=2MnO(OH)2↓,酸性条件下,MnO(OH)2将I-氧化为I2:②MnO(OH)2+I-+H+→Mn2++I2+H2O(未配平),用Na2S2O3标准溶液滴定生成的I2,③2S2O32-+I2=S4O62-+2I-
Ⅱ.测定步骤
a.安装装置,检验气密性,充N2排尽空气后,停止充N2。
b.向A中加入200mL水样
c.向A中依次迅速加入1mLMnSO4无氧溶液(过量),2mL碱性KI无氧溶液(过量),开启搅拌器,至反应①完全。
d.搅拌并向A中加入2mL硫酸无氧溶液至反应②完全,溶液为中性或弱酸性。
e.从A中取出40.00mL溶液,以淀粉作指示剂,用0.01000mol·L-1Na2S2O3溶液进行滴定,记录数据。
f.重复步骤e的操作2~3次
g.处理数据(忽略氧气从水样中的溢出量和加入试剂后水样体积的变化)。
回答下列问题:
(1)仪器A的名称为___。
(2)配置以上无氧溶液时,除去所用溶剂水中氧的简单操作为___。
(3)配平反应②的方程式。___MnO(OH)2+___I-+___H+→___Mn2++___I2+___H2O
(4)步骤e中达到滴定终点的现象为___。
(5)若某次滴定消耗Na2S2O3溶液4.50mL,水样的DO=___mg/L(保留一位小数)。
【答案】三颈烧瓶(三颈圆底烧瓶、三口烧瓶、三口瓶) 将溶剂水煮沸后冷却 1 2 4 1 1 3 溶液蓝色褪去且半分钟内不变色 9.0
【解析】
(1)根据装置图判断仪器A的名称;
(2)配制以上无氧溶液时需要通过煮沸溶液把溶剂中溶解的氧气赶出;
(3)MnO(OH)2+I-+H+→Mn2++I2+H2O,反应中碘元素化合价-1价变化为0价,锰元素化合价降低+4价变化为+2价,电子转移总数2,结合原子守恒配平离子方程式;
(4)用Na2S2O3标准溶液滴定生成的I2发生反应2S2O32-+I2═S4O62-+2I-,指示剂为淀粉;
(5)2Mn2++O2+4OH-═2MnO(OH)2↓,MnO(OH)2+2I-+4H+=Mn2++I2+3H2O,2S2O32-+I2═S4O62-+2I-,根据得到的定量关系计算水样中的DO;
(1)根据装置图,仪器A的名称是三颈烧瓶;
(2)溶液中氧气溶解度不大,且随温度升高溶解度减小,所以除去所用溶剂水中氧时需要通过煮沸后冷却,把溶剂水中溶解的氧气赶出得到;
(3)MnO(OH)2+I-+H+→Mn2++I2+H2O,反应中碘元素化合价-1价变化为0价,锰元素化合价降低+4价变化为+2价,电子转移总数2,配平得到离子方程式为:MnO(OH)2+2I-+4H+=Mn2++I2+3H2O;
(4)用Na2S2O3标准溶液滴定生成的I2发生反应2S2O32-+I2═S4O62-+2I-,以淀粉作指示剂,随硫代硫酸钠溶液滴入,滴定过程中滴入最后一滴溶液蓝色变化为无色且半分钟不变,说明反应达到终点;
(5)滴定消耗Na2S2O3溶液4.50mL,根据2Mn2++O2+4OH-═2MnO(OH)2↓,MnO(OH)2+2I-+4H+=Mn2++I2+3H2O,2S2O32-+I2═S4O62-+2I-,得到定量关系为: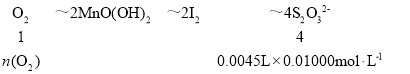
可得n(O2)=1.125×10-5mol,200mL水样中含氧气的物质的量1.125×10-5mol×![]() =5.625×10-5mol,氧气浓度=
=5.625×10-5mol,氧气浓度=![]() =2.8125×10-4mol/L,水中溶氧量(DO)=2.8125×10-4mol/L×32g/mol≈9.0mg/L。
=2.8125×10-4mol/L,水中溶氧量(DO)=2.8125×10-4mol/L×32g/mol≈9.0mg/L。

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案