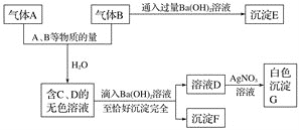
题目内容
【题目】丙烷是液化石油气主要成分之一,是一种优良的燃料。试回答下列问题:
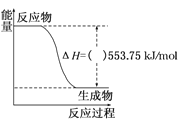
(1)如图是一定量丙烷完全燃烧生成CO2和1mol H2O(l)过程中的能量变化图,(图中的括号内填入“+”或“﹣”)_____。写出表示丙烷燃烧热的热化学方程式:_________________________
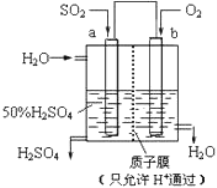
(2)科研人员设想用如图所示装置生产硫酸。
①上述生产硫酸的总反应方程式为_____________,b 是___________ 极(填“正”或“负”),b 电极反应式为______________________________,a 电极发生______________ (填“氧化反应”或“还原反应”)。②生产过程中H+向_____(填 a 或 b)电极区域运动。
(3)将两个铂电极插入氢氧化钾溶液中,向两极分别通入甲烷和氧气,可构成甲烷燃料电池,已知通入甲烷的一极为负极,其电极反应式为:_______________________。电池在放电过程中,溶液的pH值将______________ 。(填“下降”“上升”或“不变”)
【答案】- C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) △H=—2215kJ/mol 2SO2+ O2+2H2O=2H2SO4 正 O2+4e-+4H+ =2H2O 氧化反应 b CH4—8e-+10OH-=CO32-+7 H2O 下降
【解析】
(1)由图可知,丙烷完全燃烧生成CO2和1mol H2O(l)的反应放热△H=-553.75kJ/mol;
(2)原电池工作时,二氧化硫在负极失电子发生氧化反应生成硫酸,电极反应式为SO2+2H2O-2e-=SO42-+4H+,氧气在正极得电子发生还原反应,电极反应式为O2+4e-+4H+=2H2O,电子从负极沿导线流向正极,阳离子向正极移动,;
(3)燃料电池工作时,通入甲烷的一极为负极,碱性条件下,甲烷在负极失电子发生氧化反应,电极反应式为CH4-8e-+10OH-=CO32-+7H2O,通入氧气的电极是正极,氧气在正极得电子发生还原反应,电极反应式为O2+4e-+2H2O=4OH-,电池的总反应方程式为CH4+2OH-+2O2=CO32-+3H2O。
(1)由图可知,反应物的总能量大于生成物的总能量,丙烷完全燃烧生成CO2和1mol H2O(l)的反应放热△H=-553.75kJ/mol,则写出的热化学方程式为:C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H1=-2215.0kJ/mol,故答案为:— C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H1=-2215.0 kJ/mol;
(2)①由图可知,通入二氧化硫的电极是负极,二氧化硫在负极a极失电子发生氧化反应生成硫酸,电极反应式为SO2+2H2O-2e-=SO42-+4H+,通入氧气的电极是正极,氧气在正极b极得电子发生还原反应,电极反应式为O2+4e-+4H+=2H2O,则生产硫酸的总反应方程式为2SO2+ O2+2H2O=2H2SO4,故答案为:2SO2+ O2+2H2O=2H2SO4;正;O2+4e_+4H+=2H2O;氧化反应;
②生产过程中,电子从负极a极沿导线流向正极b极,阳离子向正极移动,H+向正极b极移动,故答案为:b;
(3)燃料电池工作时,通入甲烷的一极为负极,碱性条件下,甲烷在负极失电子发生氧化反应,电极反应式为CH4-8e-+10OH-=CO32-+7H2O,通入氧气的电极是正极,氧气在正极得电子发生还原反应,电极反应式为O2+4e-+2H2O=4OH-,电池的总反应方程式为CH4+2OH-+2O2=CO32-+3H2O,反应中消耗OH-,溶液的pH值将下降,故答案为:CH4—8e-+10OH-=CO32-+7 H2O;下降。

 智能训练练测考系列答案
智能训练练测考系列答案