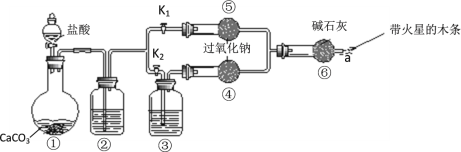
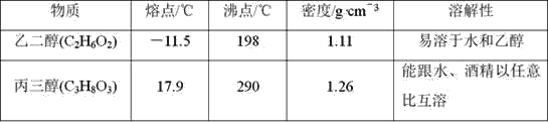
题目内容
【题目】设NA为阿伏加德罗常数的值,下列说法不正确的是
A.9g 13CO2与N217O的混合物中所含中子数目为4.6NA
B.1L 0.1 mol·L-1 Na2CO3溶液中,CO32-离子数小于0.1NA
C.7.1g Cl2与足量NaOH溶液反应转移的电子数为0.2NA
D.14g乙烯中含有的共用电子对数为3NA
【答案】C
【解析】
A.13CO2与N217O摩尔质量相同,中子数也相同;
B.根据CO32-离子会发生水解进行分析;
C.根据方程式Cl2+2NaOH=NaCl+ NaClO+H2O分析电子转移数量,进一步进行计算;
D.根据乙烯的电子式判断存在的共用电子对数量,进一步进行计算。
A. 13CO2与N217O摩尔质量均为45g/mol,中子数均为23,9g 13CO2与N217O的混合物为0.2mol,中子的物质的量为![]() =4.6mol,中子数目为4.6NA,A项正确;
=4.6mol,中子数目为4.6NA,A项正确;
B. 1L 0.1 mol·L-1 Na2CO3溶液含Na2CO30.1mol,但由于CO32-离子会发生水解,因而CO32-离子数小于0.1NA,B项正确;
C. 根据方程式Cl2+2NaOH=NaCl+ NaClO+H2O可知,消耗1molCl2电子转移1mol,7.1g Cl2是0.1mol,发生反应电子转移0.1mol,那么反应转移的电子数为0.1NA,C项错误;
D.乙烯的分子结构中存在6对共用电子,14g乙烯为0.5mol,含有的共用电子对的物质的量为3mol,故含有的共用电子对数为3NA,D项正确;
答案选C。

练习册系列答案
 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目