题目内容
18.甲、乙两个探究性学习小组,他们拟测定过氧化钠样品(含少量的Na2O)的纯度.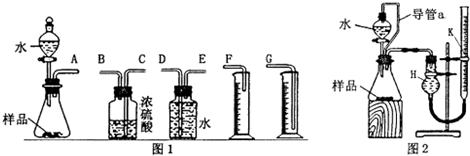
(1)甲组同学拟选用图1实验装置完成实验:
①写出实验中所发生反应的化学方程式Na2O+H2O=2NaOH,2Na2O2+2H2O=4NaOH+O2↑;
②该组同学选用最简单装置的连接顺序是:
A接E,D接G,不填接不填(填接口字母,可不填满);
(2)乙组同学仔细分析甲组同学的实验装置后,认为:水滴入锥形瓶中,即使不生成氧气,也会将瓶内空气排出,使所测氧气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氧气体积偏小.于是他们设计了图2所示的实验装置.
①装置中导管a的作用是:保持分液漏斗内气体压强与锥形瓶内气体压强相等,打开分液漏斗活塞时稀硫酸能顺利滴下;滴入锥形瓶的稀硫酸体积等于进入分液漏斗的气体体积,从而消除由于加入稀硫酸引起的氢气体积误差.
②实验结束后,在读取量气管k中液面读数时,你认为最合理的顺序是BCA (用A、B、C字母表示)
A.视线与量气管k中凹液面的最低点相平
B.等待实验装置冷却
C.上下移动量气管k,使k中液面与H中的液面相平
③若实验中样品的质量为wg,实验前后量气管k中液面读数分别为V1、V2(换算成标况).则样品的纯度为195×$\frac{{V}_{1}-{V}_{2}}{28w}$×100%(含w、V的表达式).
分析 (1)①氧化钠和水反应生成氢氧化钠,过氧化钠和水反应生成氢氧化钠和氧气;
②装置的组装顺序:合金与酸反应→用排水量气法测定氢气的体积;
②根据镁、铝与稀硫酸反应放热且生成气体使锥形瓶中气体压强变大分析;
③必须满足量筒中的液面与广口瓶的液面相平,读数时一定要平视读数;
(2)①导管a能够使锥形瓶和分液漏斗中的压强相等,据此分析对稀硫酸顺利等下的影响及对测定氢气体积的影响;
②在测量氢气体积时,为了使测量更为准确,要注意上下移动水准管,使左右两管的液面相平,以使量气管中的气压与大气气压相等,读数时视线应与左管内凹液面最低处相平,以减少观察误差;
③若实验中样品的质量为wg,实验前后量气管k中液面读数分别为V1、V2(换算成标况),过氧化钠和水反应生成的氧气物质的量=$\frac{{V}_{1}-{V}_{2}}{22.4}$mol,结合过氧化钠和水反应生成氧气的定量关系,计算得到过氧化钠质量得到过氧化钠含量.
解答 解:(1)①氧化钠和水反应生成氢氧化钠,过氧化钠和水反应生成氢氧化钠和氧气,反应的化学方程式为:Na2O+H2O=2NaOH,2Na2O2+2H2O=4NaOH+O2↑,
故答案为:Na2O+H2O=2NaOH,2Na2O2+2H2O=4NaOH+O2↑;
②装置的组装顺序:合金酸水反应,用排水量气法测定氢气的体积,其中盛水的试剂瓶导管一定要短进长出,利用增大压强原理将水排出,量筒中水的体积就是生成氢气的体积,量筒内导管应伸入量筒底部,故连接顺序为:(A)接(E)(D)接(G);
故答案为:E;D;G;
(2)①装置中导管a的作用是:保持分液漏斗内气体压强与锥形瓶内气体压强相等,打开分液漏斗活塞时稀硫酸能顺利滴下,滴入锥形瓶的稀硫酸体积等于进入分液漏斗的气体体积,从而消除由于加入稀硫酸引起的氢气体积误差,
故答案为:保持分液漏斗内气体压强与锥形瓶内气体压强相等,打开分液漏斗活塞时稀硫酸能顺利滴下;滴入锥形瓶的稀硫酸体积等于进入分液漏斗的气体体积,从而消除由于加入稀硫酸引起的氢气体积误差;
②读数时,要注意视线应于量气管凹液面的最低处保持水平;每次读数前应上下移动水准管,待两管液面相平再读数是为了防止水的压强造成的误差,实验结束后,在读取量气管k中液面读数时,最合理的顺序是BCA,
故答案为:BCA;
③若实验中样品的质量为wg,实验前后量气管k中液面读数分别为V1、V2(换算成标况),过氧化钠和水反应生成的氧气物质的量=$\frac{{V}_{1}-{V}_{2}}{22.4}$mol,结合过氧化钠和水反应生成氧气的定量关系,2Na2O2~O2,计算得到过氧化钠质量得到过氧化钠含量;Na2O2%=$\frac{\frac{{V}_{1}-{V}_{2}}{224}mol×78g/mol×2}{wg}$×100%=195×$\frac{{V}_{1}-{V}_{2}}{28w}$×100%,
故答案为:195×$\frac{{V}_{1}-{V}_{2}}{28w}$×100%.
点评 本题主要考查物质含量的测定、对实验原理与装置的理解、实验方案设计等,题目难度中等,理解实验原理是解题的关键,本题是对知识的综合考查,需要学生具有知识的基础与综合运用知识分析问题、解决问题的能力.

| A. | 棉花、蚕丝和锦纶的主要成分是纤维素 | |
| B. | 油脂在空气中完全燃烧生成二氧化碳和水 | |
| C. | 苯、乙醇和乙酸都能发生取代反应 | |
| D. | 淀粉和纤维素的组成通式为(C6H10O5)n,二者互为同分异构体 |
| A. | 氯化铵和过氧化氢的分解 | B. | 二氧化硅与二氧化碳的熔化 | ||
| C. | 蔗糖和干冰的熔化 | D. | 氯化镁和氯化铝的熔化 |
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.01 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)图中表示NO2的变化的曲线是b,用O2表示从0=2s内该反应的平均速率v(O2)=0.0015mol/(L•s).
(3)能说明该反应一定达到平衡状态的是bd

a.v(NO2)=2v(O2)
b.容器内颜色保持不变
c.2V逆 (NO)=v正(O2)
d.容器内压强保持不变
(4)能增大该反应的反应速率是bcd
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂.
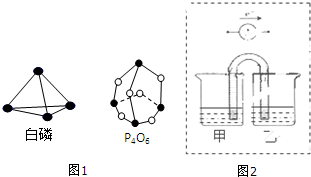
(1)化学反应可视为旧键断裂和新键生成的过程.键能是形成(或拆开)1mol化学键时释放(或吸收)的能量.已知白磷和其燃烧产物P4O6的分子结构如图1所示,现提供以下键能(kJ•mol-1):P-P:198,P-O:360,O-O:498,白磷(P4)燃烧的热化学方程式为P4(s,白鳞)+3O2(g)═P4O6(s)△H=-1638kJ•mol-1.
(2)化学能与电能之间可以相互转化,以Fe,Cu,C(石墨),CuSO4溶液、FeSO4溶液,Fe2(SO4)3溶液、AgNO3溶液为原料,通过原电池反应实现2Fe3++Cu═2Fe2++Cu2+.请你把图2补充完整,使之形成闭合电路,并用元素符号标明电极.电池中电解液时是CuSO4溶液;乙池中电解液是Fe2(SO4)3溶液.(要求:甲乙两池中电解质元素种类始终保持不变)
(3)某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5μm的悬浮颗粒物)其主要来源为燃煤、机动车尾气等.因此,对PM2.5、SO2、NOx等进行研究具有重要意义.请回答下列问题:
①对PM2.5空气样本用蒸馏水处理,制成待测试样.若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
②已知气缸中生成NO的反应为:N2(g)+O2(g)?2NO(g)△H>0
若1mol空气含有0.8molN2和0.2molO2,1300℃时在密闭容器内反应达到平衡.测得NO为8×10-4mol.计算该温度下的平衡常数K=4×10-6;汽车启动后,气缸温度越高,单位时间内NO排放量越大,原因是正反应为吸热反应,升高温度,反应速率加快,平衡右移.
 ,判断下列物质不能与B发生化学反应的有C
,判断下列物质不能与B发生化学反应的有C


 ;
; .
.