题目内容
6.下列每组物质发生的变化所克服的粒子间的相互作用完全相同的是( )| A. | 氯化铵和过氧化氢的分解 | B. | 二氧化硅与二氧化碳的熔化 | ||
| C. | 蔗糖和干冰的熔化 | D. | 氯化镁和氯化铝的熔化 |
分析 根据晶体类型判断,相同类型的晶体,克服的相互作用力相同;离子晶体克服的是离子键,分子晶体的是分子间作用力,原子晶体克服的是共价键,金属晶体克服的是金属键.
解答 解:A.氯化铵为离子化合物,分解破坏离子键,过氧化氢为共价化合物,分解破坏共价键,故A不选;
B.二氧化硅为原子晶体,熔化破坏共价键,二氧化碳为分子晶体,熔化破坏分子间作用力,故B不选;
C.蔗糖和干冰都为分子晶体,熔化破坏分子间作用力,故C选;
D.氯化镁为离子化合物,氯化铝为共价化合物,熔化分别破坏离子键、共价键,故D不选.
故选C.
点评 本题考查晶体类型与化学键,注意此类题的解题方法是:先判断晶体类型,再判断微粒间的作用力,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
17.下列指定溶液中一定能大量共存的离子组是( )
| A. | pH=1的溶液中:$NH_4^+、N{a^+}、F{e^{3+}}、SO_4^{2-}$ | |
| B. | 含有大量$AlO_2^-$的溶液中:$N{a^+}、{K^+}、HCO_3^-、NO_3^-$ | |
| C. | 中性溶液中:${K^+}、A{l^{3+}}、C{l^-}、SO_4^{2-}$ | |
| D. | Na2S溶液中:$SO_4^{2-}、{K^+}、C{u^{2+}}、C{l^-}$ |
1.蛇文石矿可以看作是由MgO、Fe2O3、Al2O3、SiO2组成.由蛇文石制取碱式碳酸镁的实验步骤如下:

(1)蛇文石矿加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是Fe3+、Al3+.
(2)进行Ⅰ操作时,控制溶液pH=7~8(有关氢氧化物沉淀的pH见下表)
Ca(OH)2不能过量,若Ca(OH)2过量会导致Al(OH)3溶解、生成Mg(OH)2沉淀.
(3)从沉淀混合物A中提取红色氧化物做颜料,先向沉淀物A中加入NaOH或Ca(OH)2(填物质的化学式),然后过滤、洗涤、灼烧(依次填写实验操作名称).
(4)物质循环使用可节约能源.上述实验中,可以循环使用的物质是碳酸钙或二氧化碳(填写物质的名称).
(5)设计一个实验,确定产品a MgCO3•b Mg(OH)2•cH2O中的a、b、c的值.将32.8g产品完全分解后,产生13.2g CO2和16.0g MgO.由此可知,产品的化学式中a:b:c=3:1:3.(填最简整数比)

(1)蛇文石矿加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是Fe3+、Al3+.
(2)进行Ⅰ操作时,控制溶液pH=7~8(有关氢氧化物沉淀的pH见下表)
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.3 | 9.6 |
(3)从沉淀混合物A中提取红色氧化物做颜料,先向沉淀物A中加入NaOH或Ca(OH)2(填物质的化学式),然后过滤、洗涤、灼烧(依次填写实验操作名称).
(4)物质循环使用可节约能源.上述实验中,可以循环使用的物质是碳酸钙或二氧化碳(填写物质的名称).
(5)设计一个实验,确定产品a MgCO3•b Mg(OH)2•cH2O中的a、b、c的值.将32.8g产品完全分解后,产生13.2g CO2和16.0g MgO.由此可知,产品的化学式中a:b:c=3:1:3.(填最简整数比)


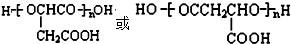 .
.