题目内容
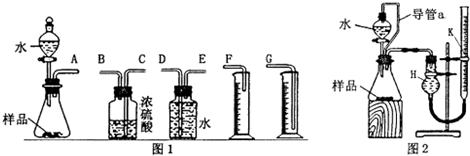
13.A-G均为有机化合物,其中A为二卤代烃,相对分子质量为216,碳的质量分数为22.2%.相关转化关系如下:
已知:

请回答:
(1)C的核磁共振氢谱有2个吸收峰.
(2)①、④的反应类型分别为消去反应、氧化反应.
(3)下列关于F的说法正确的是ad (填选项字母).
a.1mol F与足量金属钠反应最多生成2mol H2
b.1mol F完全燃烧消耗8.5mol O2
c.能与新制Cu(OH)2反应生成砖红色沉淀
d.能与NaHCO3反应生成CO2
(4)写出下列反应的化学方程式
反应③BrCH2CH2CH2CH2Br+2NaOH→H2O△→H2O△HOCH2CH2CH2CH2OH+2NaBr;反应⑤
 ;
;(5)符合下列条件的同分异构体有9种,任写其中一种的结构简式
 .
.i.与E互为同系物 ii.相对分子质量比E大28.
分析 A为二卤代烃,相对分子质量为216,碳的质量分数为22.2%,则A中的碳原子数为216×22.212216×22.212=4,根据A→B→C的变化,及C的结构简式可知,B为1,3-丁二烯,A的分子式可写为C4H8X2,则X的相对原子质量为 216−12×4−82216−12×4−82=80,故X为Br.根据G的结构,可推知F的结构简式为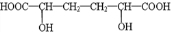 ,根据已知信息,可知E为OHC-CH2-CH2-CHO,逆推可知D为HOCH2CH2CH2CH2OH,则A为BrCH2CH2CH2CH2Br,据此解答.
,根据已知信息,可知E为OHC-CH2-CH2-CHO,逆推可知D为HOCH2CH2CH2CH2OH,则A为BrCH2CH2CH2CH2Br,据此解答.
解答 解:A为二卤代烃,相对分子质量为216,碳的质量分数为22.2%,则A中的碳原子数为216×22.212216×22.212=4,根据A→B→C的变化,及C的结构简式可知,B为1,3-丁二烯,A的分子式可写为C4H8X2,则X的相对原子质量为 216−12×4−82216−12×4−82=80,故X为Br.根据G的结构,可推知F的结构简式为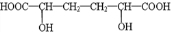 ,根据已知信息,可知E为OHC-CH2-CH2-CHO,逆推可知D为HOCH2CH2CH2CH2OH,则A为BrCH2CH2CH2CH2Br,
,根据已知信息,可知E为OHC-CH2-CH2-CHO,逆推可知D为HOCH2CH2CH2CH2OH,则A为BrCH2CH2CH2CH2Br,
(1)C有两种氢原子,所以C的核磁共振氢谱有2个吸收峰,故答案为:2;
(2)通过以上分析知,①、④的反应类型分别为消去反应、氧化反应,
故答案为:消去反应;氧化反应;
(3)F的结构简式为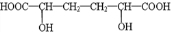 ,
,
a.醇羟基和羧基都能和钠反应生成氢气,所以1mol F与足量金属钠反应最多生成2mol H2,故正确;
b.F分子式为C6H10O6,可以改写为C3H10.(CO2)3,1mol F完全燃烧消耗O2物质的量=(3+104104)×1mol=5.5mol,故错误;
c.不含醛基,所以不能与新制Cu(OH)2反应生成砖红色沉淀,但能和新制氢氧化铜悬浊液发生中和反应,故错误;
d.含有羧基,所以能与NaHCO3反应生成CO2,故正确;
故选ad;
(4)写出下列反应的化学方程式
反应③为1,4-二溴丁烷的取代反应,反应方程式为BrCH2CH2CH2CH2Br+2NaOH→H2O△→H2O△HOCH2CH2CH2CH2OH+2NaBr;
反应⑤为酯化反应,反应方程式为 ,
,
故答案为:BrCH2CH2CH2CH2Br+2NaOH→H2O△→H2O△HOCH2CH2CH2CH2OH+2NaBr; ;
;
(5)同分异构体符合下列条件:i.与E互为同系物说明含有两个醛基,且除了醛基外其它为饱和烃基,ii.相对分子质量比E大28,说明比E多两个-CH2原子团,符合条件的结构简式为 ,所以有9种,
,所以有9种,
故答案为:9; .
.
点评 本题考查有机物结构和性质,为高频考点,侧重考查学生分析推断能力,根据G结构简式采用逆推方法进行推断,注意结合反应条件分析,难点是(5)题同分异构体种类判断,要考虑碳链异构、官能团位置异构,题目难度中等.

| A. | 2,3-二甲基戊烷 | B. | 2,2,3-三甲基丁烷 | ||
| C. | 3,3-二甲基丁烷 | D. | 3-甲基-2-乙基戊烷 |
 碳、氮的化合物在工农业生产中应用广泛.
碳、氮的化合物在工农业生产中应用广泛.(1)在一定条件下,联氨(N2H4)与H2O2反应生成N2和H2O.反应过程中的能量变化如图所示.该反应属于放热反应.(填写“吸热反应”或“放热反应”).
甲胺(CH3NH2)在水溶液中发生反应:CH3NH2+H2O?CH3NH2.H2O?CH3CH3++OH-,
CH3NH3Cl溶液中离子浓度的大小顺序为c(Cl-)>c(CH3NH3+)>c(H+)>c(OH-).
(2)工业上可采用CO与H2合成甲醇,反应方程式为:CO(g)+2H2(g)?CH3OH(g)△H<0
T1℃时,在容积为2L的两个密闭容器中充入CO、H2进行实验,反应过程中部分数据如下表所示:
| 序号 | 实验条件 | 反应时间 | CO(g)/mol | H2(g)/mol | CH3OH(g)/mol |
| 实验Ⅰ | 恒温恒容 | 0min | 2 | 4 | 0 |
| 10min | 2.8 | ||||
| 20min | 1 | ||||
| 实验Ⅱ | 绝热恒容 | 0min | 2 | 4 | 0 |
②对于实验I,20min时反应达平衡,其它条件不变,若向容器中再充入0.1molCO(g)和0.2mol CH3OH(g),则平衡逆向移动(填“正向”、“逆向”或“不”);若将温度变为T2℃,再次达到平衡时CH3OH的物质的量为1.2mol,则CO的转化率为60%.
③实验I、Ⅱ均达到平衡时,平衡常数KI>KⅡ(填“>”、“<”或“=”).
(3)T℃时,将碳酸钡加入Na2SO4溶液中,沉淀发生转化,写出反应的离子方程式BaCO3(s)+SO42-(aq)=BaSO4(s)+CO32-(aq).反应后过滤,所得滤液呈碱性(填写“碱性”、“酸性”或“中性”).

(1)蛇文石矿加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是Fe3+、Al3+.
(2)进行Ⅰ操作时,控制溶液pH=7~8(有关氢氧化物沉淀的pH见下表)
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.3 | 9.6 |
(3)从沉淀混合物A中提取红色氧化物做颜料,先向沉淀物A中加入NaOH或Ca(OH)2(填物质的化学式),然后过滤、洗涤、灼烧(依次填写实验操作名称).
(4)物质循环使用可节约能源.上述实验中,可以循环使用的物质是碳酸钙或二氧化碳(填写物质的名称).
(5)设计一个实验,确定产品a MgCO3•b Mg(OH)2•cH2O中的a、b、c的值.将32.8g产品完全分解后,产生13.2g CO2和16.0g MgO.由此可知,产品的化学式中a:b:c=3:1:3.(填最简整数比)
(1)如图1是1mol NO2气体和1mol CO气体反应生成CO2气体和NO气体过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:NO2(g)+CO(g)═CO2(g)+NO(g)△H=-234kJ•mol-1;
已知:N2 (g)+2NO2 (g)?4NO(g)△H=+292.3kJ•mol-1,
则反应:2NO(g)+2CO(g)?N2(g)+2CO2(g) 的△H=-760.3kJ•mol-1;
(2)一定温度下,在体积为2L的恒容密闭容器中充入20mol NO2和5molO2发生反应:4NO2(g)+O2(g)?2N2O5(g);已知体系中n(NO2)随时间变化如下表:
| t(s) | 0 | 500 | 1000 | 1500 |
| n(NO2)(mol) | 20 | 13.96 | 10.08 | 10.08 |
②反应达到平衡后,NO2的转化率为49.6%,若要增大NO2的转化率,可采取的措施有AD
A.降低温度 B.充入氦气,使体系压强增大
C.再充入NO2 D.再充入4mol NO2和1mol O2
③图2中表示N2O5的浓度的变化曲线是C,用O2表示从0~500s内该反应的平均速率v=0.00151mol•L-1•s-1.

| A. | 属于高分子化合物 | |
| B. | 水解后可得到多种氨基酸 | |
| C. | 可用于蛋白质反应机理的研究 | |
| D. | 加入CuSO4溶液后所得的沉淀能用溶于水 |
| A. | ②④③① | B. | ②③① | C. | ②④③⑤① | D. | ②⑤③① |