题目内容
700℃时,向容积为1 L的密闭容器中充入一定量的CO2和H2,发生反应:
CO2+H2(g) CO(g)+H2O(g) 反应过程中测定的部分数据见下表(表中t2>t1):
CO(g)+H2O(g) 反应过程中测定的部分数据见下表(表中t2>t1):
下列说法不正确的是
A.反应在t1 min内的平均速率为v(H2O)=0.60 /t1 mol·L-1·min-1
B.温度升至800℃,上述反应平衡常数为1.56,则正反应为放热反应
C.保持其他条件不变,向平衡体系中再通入1.00 molH2,与原平衡相比,达到新平时CO2转化率增大,H2的体积分数增大
D.保持其他条件不变,起始时向容器中充入1.00 molCO和1.50 molH2O,到达平衡时,c(CO2)=0.90 mol/L
CO2+H2(g)
 CO(g)+H2O(g) 反应过程中测定的部分数据见下表(表中t2>t1):
CO(g)+H2O(g) 反应过程中测定的部分数据见下表(表中t2>t1):| 反应时间/min | n(CO2)/mol | H2/ mol |
| 0 | 1.50 | 1.00 |
| t1 | | 0.40 |
| t2 | 0.90 | |
A.反应在t1 min内的平均速率为v(H2O)=0.60 /t1 mol·L-1·min-1
B.温度升至800℃,上述反应平衡常数为1.56,则正反应为放热反应
C.保持其他条件不变,向平衡体系中再通入1.00 molH2,与原平衡相比,达到新平时CO2转化率增大,H2的体积分数增大
D.保持其他条件不变,起始时向容器中充入1.00 molCO和1.50 molH2O,到达平衡时,c(CO2)=0.90 mol/L
BD
试题分析:A、反应在t1 min内,氢气的物质的量减少0.6mol,则水蒸气的物质的量增加0.6mol,浓度增加0.6mol/L,所以t1 min内平均速率为v(H2O)=0.6mol/L/t1 min="0.60" /t1 mol·L-1·min-1,正确;B、由表中所给数据可计算t1 min时n(CO2)=0.9mol,与t2min时的n(CO2)相等,说明t1 min时反应已达平衡状态,计算该温度下的化学平衡常数K=1,而800℃,上述反应平衡常数为1.56,升高温度,平衡常数增大,说明升高温度,平衡正向移动,正向是吸热反应,错误;C、保持其他条件不变,向平衡体系中再通入1.00 molH2,则会增大CO2转化率,而本身的转化率降低,H2的体积分数增大 ,正确;D、保持其他条件不变,起始时向容器中充入1.00 molCO和1.50 molH2O,反应从逆反应开始,因为该反应的平衡常数为1,可计算达平衡时CO转化的浓度是0.6mol/L,所以到达平衡时,c(CO2)=0.60 mol/L,错误,答案选BD。

练习册系列答案
 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案
相关题目
 xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,C的平均反应速率为0.1 mol/(L·min)。试求:
xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,C的平均反应速率为0.1 mol/(L·min)。试求: (正反应放热)。测得n(O2)随时间的变化如下表
(正反应放热)。测得n(O2)随时间的变化如下表

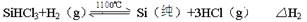
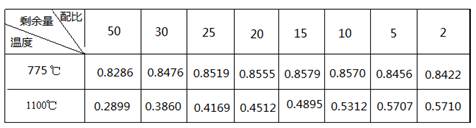
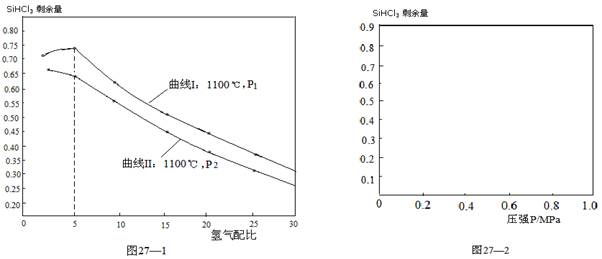
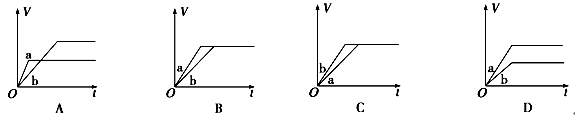
 2CO(g),下列描述中能说明该反应已达到化学平衡状态的是________________。
2CO(g),下列描述中能说明该反应已达到化学平衡状态的是________________。 2C(g)+2D(g),在不同条件下的化学反应速率,其中反应速率最快的是( )
2C(g)+2D(g),在不同条件下的化学反应速率,其中反应速率最快的是( )