题目内容
称取三份锌粉,分别盛于甲、乙、丙三支试管中,按下列要求另加物质后,塞上塞子,定时测定生成氢气的体积。甲加入50 mL pH=3的盐酸,乙加入50 mL pH=3的醋酸,丙加入50 mL pH=3的醋酸及少量胆矾粉末。若反应终了,生成氢气的体积一样多,且没有剩余的锌。请用“>”“=”或“<”回答下列各题。
(1)开始时,反应速率的大小为 。
(2)三支试管中参加反应的锌的质量为 。
(3)反应终了,所需时间为 。
(4)在反应过程中,乙、丙速率不同的理由是(简要说明) 。
(1)开始时,反应速率的大小为 。
(2)三支试管中参加反应的锌的质量为 。
(3)反应终了,所需时间为 。
(4)在反应过程中,乙、丙速率不同的理由是(简要说明) 。
(1)甲=乙=丙 (2)甲=乙<丙 (3)甲>乙>丙(4)因丙形成原电池,加快了反应速率。
试题分析:(1)开始时,四种溶液的pH相等,氢离子浓度相等,反应速率的大小为甲=乙=丙。(2)三支试管中生成氢气的体积一样多,丙中有少量锌和硫酸铜反应,参加反应的锌的质量为甲=乙<丙。(3)随着反应的进行,乙和丙中醋酸不断电离,氢离子浓度大于甲,丙中加入了胆矾,形成原电池,故反应速率:甲<乙<丙,所需时间为甲>乙>丙。(4)在反应过程中,乙、丙速率不同的理由是因丙形成原电池,加快了反应速率。

练习册系列答案
相关题目
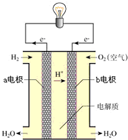
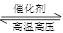 2NH3(g),在不同条件下的化学反应速率如下,其中表示反应速率最快的是
2NH3(g),在不同条件下的化学反应速率如下,其中表示反应速率最快的是  C+5D反应中,表示该反应速率最快的是( )
C+5D反应中,表示该反应速率最快的是( ) N2(g)+CO2(g)+2H2O(g) ΔH=a kJ/mol 在温度T1和T2时,分别将0.50 mol CH4和1.2 mol NO2充入体积为1 L的密闭容器中,测得n(CH4)随时间变化数据如下表:
N2(g)+CO2(g)+2H2O(g) ΔH=a kJ/mol 在温度T1和T2时,分别将0.50 mol CH4和1.2 mol NO2充入体积为1 L的密闭容器中,测得n(CH4)随时间变化数据如下表: xC(g)+D(g)中,已知:反应开始加入的物质只有A、B;起始浓度A为5 mol·L-1,B为3 mol·L-1,前2 min C的平均反应速率为0.5 mol·L-1·min-1。2 min后,测得D的浓度为0.5 mol·L-1。(设反应前后溶液体积不变)则关于此反应的下列说法中正确的是( )
xC(g)+D(g)中,已知:反应开始加入的物质只有A、B;起始浓度A为5 mol·L-1,B为3 mol·L-1,前2 min C的平均反应速率为0.5 mol·L-1·min-1。2 min后,测得D的浓度为0.5 mol·L-1。(设反应前后溶液体积不变)则关于此反应的下列说法中正确的是( ) 2C(g)+D(g) △H<0的平衡移动图像,影响平衡移动的原因可能是 ( )
2C(g)+D(g) △H<0的平衡移动图像,影响平衡移动的原因可能是 ( )
 CO(g)+H2O(g) 反应过程中测定的部分数据见下表(表中t2>t1):
CO(g)+H2O(g) 反应过程中测定的部分数据见下表(表中t2>t1):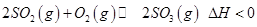 是制备硫酸的重要反应。下列说法正确的是
是制备硫酸的重要反应。下列说法正确的是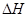 变大
变大