题目内容
20.为了使Na2S溶液中$\frac{c(N{a}^{+})}{{c(S}^{2-})}$的比值变小,可采取的措施是( )①加适量盐酸②加适量NaOH(s)③加适量KOH(s)
④加适量KHS(s)⑤加水⑥通H2S(g)⑦加热.
| A. | ②③④ | B. | ①②⑤⑥⑦ | C. | ②③ | D. | ③④ |
分析 硫化钠是强碱弱酸盐,硫离子水解导致该溶液呈碱性,要使$\frac{c(N{a}^{+})}{c({S}^{2-})}$减小,可以采用增大硫离子浓度或减小钠离子浓度来实现,据此分析解答.
解答 解:①硫离子水解呈碱性,加适量盐酸,促进水解,导致硫离子浓度降低,$\frac{c(N{a}^{+})}{c({S}^{2-})}$增大,故错误;
②加适量NaOH(s),钠离子浓度增大且抑制硫离子水解,且钠离子增大程度远远大于抑制硫离子水解程度,所以$\frac{c(N{a}^{+})}{c({S}^{2-})}$增大,故错误;
③加适量KOH(s),钠离子浓度不变,但抑制硫离子水解,所以硫离子浓度增大,则$\frac{c(N{a}^{+})}{c({S}^{2-})}$减小,故正确;
④加适量KHS(s),钠离子浓度不变,硫氢根离子抑制硫离子水解,所以硫离子浓度增大,$\frac{c(N{a}^{+})}{c({S}^{2-})}$减小,故正确;
⑤加水,促进硫离子水解,钠离子物质的量不变、硫离子物质的量减小,所以$\frac{c(N{a}^{+})}{c({S}^{2-})}$增大,故错误;
⑥通H2S(g),硫离子和硫化氢反应生成硫氢根离子,所以硫离子浓度降低,$\frac{c(N{a}^{+})}{c({S}^{2-})}$增大,故错误;
⑦加热促进硫离子水解,硫离子浓度降低,所以$\frac{c(N{a}^{+})}{c({S}^{2-})}$增大,故错误;
故选D.
点评 本题考查盐类水解,为高频考点,明确改变条件时各离子浓度变化是解本题关键,注意通入硫化氢时会导致硫离子浓度降低,很多同学往往认为硫化氢电离导致硫离子浓度增大而错误,为易错点.

练习册系列答案
相关题目
11.配制250mL 0、1000mol/LNaCl溶液时,下列操作会使配得溶液中NaCl的物质的量浓度偏大的是( )
| A. | 移液后未洗涤烧杯 | |
| B. | 在容量瓶中进行定容时,仰视刻度线 | |
| C. | 在容量瓶中进行定容时,俯视刻度线 | |
| D. | 定容后摇匀,发现液面低于刻度线,再加水至刻度线 |
8.下列说法正确的是( )
| A. | 用钠制取钛:TiCl4+4Na=4NaCl+Ti该反应转移4e- | |
| B. | SO2+2H2S=3S↓+2H2O中,氧化产物与还原产物的物质的量之比为2:3 | |
| C. | SiO2+3C$\frac{\underline{\;高温\;}}{\;}$SiC+2CO↑中,二氧化硅是氧化剂,C是还原剂 | |
| D. | HgS+O2$\frac{\underline{\;\;△\;\;}}{\;}$Hg+SO2中,每生成1molHg反应转移4mole- |
5.一定温度下,在容积为3L的密闭容器内发生反应CO(g)+H2O(g)?H2(g)+CO2(g)△H<0,起始时充入1mol CO和1mol H2O(g),2min后反应达到平衡状态,此时CO2的浓度为0.2mol•L-1,下列说法正确的是( )
| A. | 达到平衡时CO2的体积分数为20% | |
| B. | 降低温度,正反应速率减小程度比逆反应速率减小程度大 | |
| C. | 加入催化剂,改变了反应的途径,反应的△H也随之改变 | |
| D. | 在达平衡的过程中,任意时刻CO和H2O的转化率都相同 |
6.X、Y、Z、W、Q都是短周期元素,其中X原子的最外层电子数是内层电子数的3倍;X与Z同族,Y与Z同周期,Q原子的电子总数等于其电子层数的3倍,W与X、Y既不同族也不同周期且W不为稀有气体元素;X、Y、Z三种元素的族序数之和为16.下列说法正确的是( )
| A. | Q与W能形成10电子,不能形成14电子、18电子分子 | |
| B. | Y的最高价氧化物对应水化物的化学式只能表示为H4YO4 | |
| C. | Y、Z、Q分别与X化合,只能形成AB2型化合物 | |
| D. | X、Z、W三种元素形成的两种钠盐溶液发生化学反应生成的气体可使品红溶液褪色 |
 制备水杨酸对正辛基苯基酯(
制备水杨酸对正辛基苯基酯(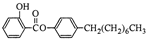 )如下:
)如下: (水杨酸)+SOCl2→
(水杨酸)+SOCl2→ (水杨酰氯)+HCl↑+SO2↑
(水杨酰氯)+HCl↑+SO2↑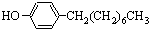 ],温度控制在100℃左右,不断搅拌.
],温度控制在100℃左右,不断搅拌. .
.