题目内容
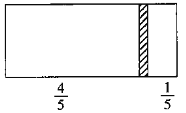
【题目】一个密闭容器,中间有一可自由滑动的隔板(厚度可忽略)将容器分成两部分。当左边充入2molN2,右边充入CO和CO2的混合气体共18g时,隔板处于如图位置(左、右两侧温度相同)。右侧CO2与CO分子数之比为( )
A.3:1B.1:1C.1:2D.1:3
【答案】B
【解析】
根据阿伏加德罗定律的推论:同温同压下,气体的体积之比等于物质的量之比,据此计算一氧化碳、二氧化碳总的物质的量,结合质量守恒定律计算解答。
依据图示可知:左右两边气体体积之比为:![]() :
:![]() =4:1,左边为2mol氮气,依据同温同压下,气体的体积之比等于物质的量之比,则右边物质的量为:0.5mol,设CO和CO2的物质的量分别为xmol、ymol,则:x+y=0.5;28x+44y=18g,联立解得x=y=0.25,由分子数目之比等于物质的量之比,可知右边CO与CO2分子数之比为1:1,B项正确;
=4:1,左边为2mol氮气,依据同温同压下,气体的体积之比等于物质的量之比,则右边物质的量为:0.5mol,设CO和CO2的物质的量分别为xmol、ymol,则:x+y=0.5;28x+44y=18g,联立解得x=y=0.25,由分子数目之比等于物质的量之比,可知右边CO与CO2分子数之比为1:1,B项正确;
答案选B。

练习册系列答案
相关题目
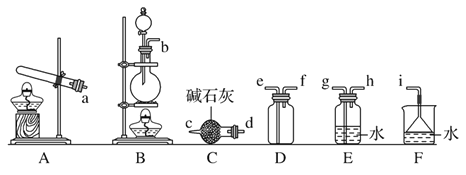
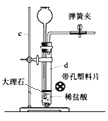
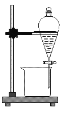
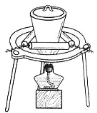
【题目】完成下列实验所选择的装置或仪器(夹持装置已略去)正确的是( )
A | B | C | D | |
实验 | 制取少量纯净的CO2气体 | 用CCl4提取溴水中的Br2 | 除去CO2中少量的HCl | 蒸干NaCl饱和溶液制备NaCl晶体 |
装置或仪器 |
|
|
|
|
A.AB.BC.CD.D