题目内容
【题目】如图所示是在一定温度下向不同电解质溶液中加入新物质时其电流强度(I)随新物质加入量(V)的变化曲线。(假设混合溶液体积等于二者体积之和)下列说法正确的是( )
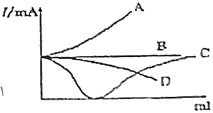
A.向醋酸溶液中逐滴加入等浓度的氨水至恰好完全反应
B.向Ba(OH)2溶液中逐滴加入等浓度的H2SO4至过量
C.向盐酸溶液中逐滴加入等浓度的NaOH溶液过量
D.向氨水中滴加浓硝酸溶液
【答案】A
【解析】
A. 向醋酸溶液中逐滴加入等浓度的氨水至恰好完全反应,CH3COOH+NH3H2O=CH3COONH4+H2O,弱电解质溶液变为强电解质溶液,导电性增强,与图象一致,A项正确;
B. 向Ba(OH)2溶液中逐滴加入等浓度的H2SO4,发生反应Ba(OH)2+H2SO4=BaSO4↓+2H2O,导电性减弱,完全反应后,H2SO4过量,导电性又增强,与图象不一致,B项错误;
C. 向盐酸溶液中逐滴加入等浓度的NaOH溶液会发生反应得到氯化钠溶液,溶液的体积变大,溶液导电性减弱,但是仍具有导电性,至过量相当于将溶液稀释,所以溶液导电性继续减弱,和图象不一致,C项错误;
D. 向氨水中滴加浓硝酸溶液会发生反应得到硝酸铵溶液,弱电解质溶液变为强电解质溶液,导电性增强,和图象不一致,D项错误;
答案选A。

【题目】H2是一种重要的清洁能源。
(1)已知:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH2=-49.0kJmol-1
CH3OH(g)+H2O(g) ΔH2=-49.0kJmol-1
CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH3=-41.1kJmol-1
CO2(g)+H2(g) ΔH3=-41.1kJmol-1
H2还原 CO反应合成甲醇的热化学方程式为:CO(g)+2H2(g)![]() CH3OH(g) ΔH1,则ΔH1=___kJmol-1,该反应自发进行的条件为___
CH3OH(g) ΔH1,则ΔH1=___kJmol-1,该反应自发进行的条件为___
A.高温 B.低温 C.任何温度条件下
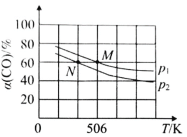
(2)恒温恒压下,在容积可变的密闭容器中加入 1molCO和2.2mol H2,发生反应CO(g)+2H2(g)![]() CH3OH(g),实验测得平衡时CO的转化率随温度、压强的变化如图所示。则P1__P2,判断的理由是_____。
CH3OH(g),实验测得平衡时CO的转化率随温度、压强的变化如图所示。则P1__P2,判断的理由是_____。
(3)若反应 CO(g)+2H2(g)![]() CH3OH(g)在温度不变且体积恒定为1的密闭容器中发生,反应过程中各物质的物质的量随时间变化如表所示:
CH3OH(g)在温度不变且体积恒定为1的密闭容器中发生,反应过程中各物质的物质的量随时间变化如表所示:
时间/min | 0 | 5 | 10 | 15 |
H2 | 4 | 2 | ||
CO | 2 | 1 | ||
CH3OH(g) | 0 | 0.7 |
①下列各项能作为判断该反应达到平衡标志的是____(填字母);
A.容器内压强保持不变 B.2v正
C.混合气体的相对分子质量保持不变 D.混合气体的密度保持不变
②若起始压强为P0 kPa,则在该温度下反应的平衡常数Kp=___(kPa)-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③反应速率若用单位时间内分压的变化表示,则10min内H2的反应速率v(H2)=___kPamin-1。