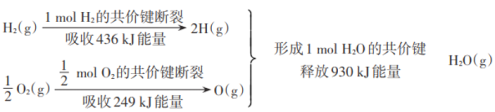
题目内容
【题目】某强酸性溶液中还可能存在Al3+、Fe2+、NH4+、Ba2+、Cl-、CO32-、SO42-、NO3-中的若干种,现取适量溶液进行如下一系列实验
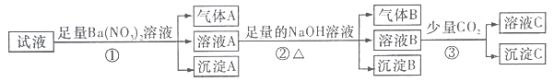
下列有关判断正确的是( )
A. 原试液中一定有Fe2+、SO42-、H+、NH4+、Al3+
B. 原试液中一定没有Ba2+、CO32-、NO3-
C. 步骤③中发生反应的离子方程式为: 2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
D. 沉淀B在空气中由白色迅速变成灰绿色,最终变为红褐色
【答案】B
【解析】
已知溶液为强酸性,则存在大量的H+,与H+反应的CO32-不存在,根据流程可知,加入硝酸钡产生气体、沉淀,则溶液中存在Fe2+、SO42-,与此离子反应的Ba2+、NO3-不存在;加入足量的NaOH溶液时,产生气体和沉淀,为氨气和氢氧化铁,则溶液中含有NH4+;通入少量二氧化碳产生沉淀为氢氧化铝或碳酸钡,溶液中可能含有Al3+。
A. 原试液中一定有Fe2+、SO42-、H+、NH4+,可能含有Al3+,A错误;
B. 通过分析可知,原试液中一定没有Ba2+、CO32-、NO3-,B正确;
C. 步骤③中发生反应的离子方程式可能有2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-,一定有:CO2+2OH-+ Ba2+= BaCO3↓+H2O,C错误;
D. 沉淀B为氢氧化铁,为红褐色沉淀,D错误;
答案为B。

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案【题目】下表是A、B、C三种有机物的相关信息:
A | ①能使溴的四氯化碳溶液褪色;②填充模型为: |
B | ①可以从煤干馏生成的煤焦油中提取;②填充模型为: |
C | 工业生产中可通过A与H2O加成获得;②相对分子质量为46 |
请结合上述信息,回答下列问题:
(1)有机物A的结构式为___________
(2)B与浓硝酸在一定条件下发生反应的化学方程式为__________
(3)有机物C的结构简式为__________。
(4)①C与乙酸反应的化学方程式为____________
②C在铜催化和加热条件下,与O2反应的化学方程式为___________。