题目内容
【题目】下图为H2(g)和O2(g)生成H2O(g)过程中的能量变化。下列叙述中正确的是

A.该反应中反应物所具有的总能量低于生成物所具有的总能量
B.2 mol O(g)原子结合成O2(g)时,吸收498kJ能量
C.1 mol H2(g)和0.5 mol O2(g)反应生成1 mol H2O(g)时,放热245kJ
D.1 mol H2(g)和0.5 mol O2(g)反应生成1 mol H2O(l)时,释放的热量小于245kJ
【答案】C
【解析】
A.从题干可知,化学键断裂过程中吸收的能量为436kJ+249kJ=685kJ,小于形成化学键过程中释放的能量930kJ,该反应是放热反应,则反应物所具有的总能量高于生成物所具有的总能量,A不正确;
B.2 mol O(g)原子结合成O2(g)是化学键的形成过程,将释放498kJ能量,B不正确;
C.1 mol H2(g)和0.5 mol O2(g)反应生成1 mol H2O(g)时,放热930kJ-436kJ-249kJ=245kJ,C正确;
D.由于水蒸气转化为液态水的过程中会继续释放热量,故1 mol H2(g)和0.5 mol O2(g)反应生成1 mol H2O(l)时,释放的热量大于245kJ,D不正确;
故答案为:C。

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
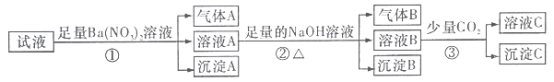
综合自测系列答案【题目】常温下浓度均为0.1mol/L 的四种盐溶液,其pH 如表所示,下列说法正确的是( )
序号 | ① | ② | ③ | ④ |
溶液 | CH3COONa | NaHCO3 | Na2CO3 | NaClO |
pH | 8.8 | 9.7 | 11.6 | 10.3 |
A. 将等浓度的CH3COOH 和HClO溶液,pH小的是HClO
B. Na2CO3和NaHCO3溶液中粒子种类不同
C. 溶液水的电离程度:①>②>④>③
D. NaHCO3溶液中:c (Na+) =c (CO32- )+c (HCO3- )+c (H2CO3)
【题目】根据所给的实验装置,下列有关实验的相关叙述正确的是
选项 | 实验装置 | 相关叙述 |
A |
| 实验室可以用该装置和药品制取氨气 |
B |
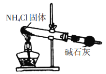
| 反应过程中,温度降低,Ba(OH)2·8H2O与NH4Cl反应是吸热反应 |
C |
| ①中反应比②中快,说明温度升高可以加快反应速率 |
D |
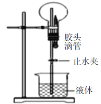
| 只有氨气等极易溶于水的气体才能利用该装置形成喷泉 |
A.AB.BC.CD.D