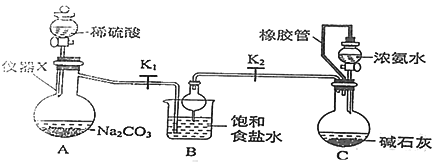
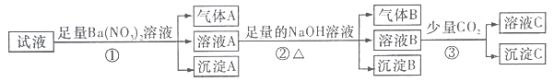
题目内容
【题目】工业上除去电石渣浆(含CaO)上清液中的S2-,并制取石膏( CaSO42H2O)的常用流程如下:
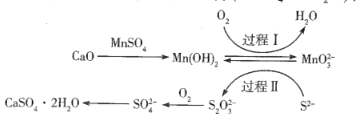
下列说法正确的是
A.Mn(OH)2、MnO32-在过程I、II中均起催化剂作用
B.过程I中,反应的离子方程式为2Mn(OH)2 +O2 +4OH-=2MnO32- +4H2O
C.将10L上清液中的S2 -转化为SO42-(S2-浓度为480 mg·L-1),理论上共需要0.03mol的O2
D.常温下,56 g CaO溶于水配成1 L溶液,溶液中Ca2+的数目为6.02 ×1023个
【答案】B
【解析】
A. Mn(OH)2在过程I化合价升高,作还原剂,MnO32在过程II中化合价降低,作氧化剂,故A错误;
B. 过程I中,根据化合价升降守恒得到反应的离子方程式为2Mn(OH)2 +O2 +4OH-= 2MnO32 +4H2O,故B正确;
C. 将10L上清液中的S2转化为SO42 (S2浓度为480 mg·L-1),质量为480 mg·L1×10L = 4800mg=4.8g,物质的量为![]() ,根据得失电子守恒0.15mol×8=n(O2)×4,n(O2) =0.3mol,理论上共需要0.3mol的O2,故C错误;
,根据得失电子守恒0.15mol×8=n(O2)×4,n(O2) =0.3mol,理论上共需要0.3mol的O2,故C错误;
D. 常温下,饱和石灰水的物质的量浓度为0.002 molL1,因此56 g CaO溶于水配成1 L溶液,是饱和溶液,因此1L溶液中Ca2+的数目为0.002NA个,故D错误。
综上所述,答案为B。

 53随堂测系列答案
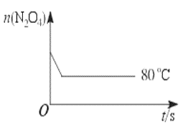
53随堂测系列答案【题目】在80 ℃时,将0.40 mol的N2O4气体充入2 L真空的固定容积的密闭容器中,发生反应:N2O4 ![]() 2NO2 △H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2 △H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
n(N2O4) /mol | 0.40 | 0.28 | 0.20 | 0.14 | 0.10 | 0.10 |
n(NO2) /mol | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
(1)计算20~40 s内用N2O4表示的平均反应速率为__________。
(2)40s时,NO2的的浓度b=_________mol/L,反应最迟到________s到达平衡状态
(3)反应进行至100 s后将反应混合物的温度降低,混合气体的颜色________(填“变浅”“变深”或“不变”)。
(4)要增大该反应的K值,可采取的措施有___________(填序号)。
A. 增大N2O4的起始浓度 B. 向混合气体中通入NO2
C. 使用高效催化剂 D. 升高温度
(5)能说明该反应达到平衡状态的标志是_________(填序号)
A. 2 v(N2O4 ) =v(NO2 ) B. 容器内压强保持不变
C. 容器内密度保持不变 D. NO2的体积分数保持不变
(6)如图是80 ℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在60 ℃时N2O4物质的量的变化曲线______。
【题目】为了探究化学反应速率和化学反应限度的有关问题,某研究小组进行了以下实验:
实验一:为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表。
(已知I2+2S2O![]() ==S4O
==S4O![]() +2I- ,其中Na2S2O3溶液均足量,且S2O
+2I- ,其中Na2S2O3溶液均足量,且S2O![]() 与S4O
与S4O![]() 均为无色)
均为无色)
实验序号 | 体积V/mL | 蓝色褪去时间/s | |||
Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 | ||
① | 10.0 | 2.0 | 4.0 | 0.0 | t1 |
② | 8.0 | 2.0 | 4.0 | 2.0 | t2 |
③ | 6.0 | 2.0 | 4.0 | Vx | t3 |
(1)表中Vx=_________mL,t1、t2、t3的大小关系是___________________
实验二:取5 mL 0.1 mol·L-1的KI溶液于试管中,滴加0.1 mol·L-1 FeCl3溶液2 mL,发生如下反应:2Fe3++2I-=2Fe2+ +I2,为证明该反应存在一定的限度,他们设计了如下实验:
①取少量反应液,滴加AgNO3溶液,发现有少量黄色沉淀(AgI)。
②再取少量反应液,滴加少量CCl4 ,振荡,发现CCl4层显浅紫色。
根据①②的现象,/span>他们得出结论:该反应具有一定的可逆性,在一定条件下会达到反应限度。
(2)指导老师指出上述实验①不合理,其原因是_______________ ; 你的改进方案是________(简要写出操作、试剂和现象)。
(3)实验②适合检验生成I2较多的情况,还有一种简便的方法可以灵敏地检验是否生成了I2,这种方法所用的试剂是_______________________。