题目内容
12.实验室欲用NaOH固体配制1.0mol/L的NaOH溶液240mL: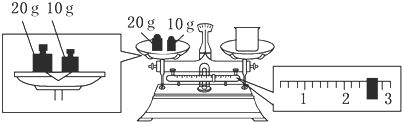
(1)配制溶液时,一般可以分为以下几个步骤:
①称量 ②计算 ③溶解 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却
其正确的操作顺序为②①③⑧⑤⑥⑦④.本实验必须用到的仪器有天平、药匙、玻璃棒、烧杯、250ml容量瓶、胶头滴管.
(2)某同学欲称量NaOH的质量,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图.烧杯的实际质量为27.4 g,要完成本实验该同学应称出10.0 g NaOH.
(3)使用容量瓶前必须进行的一步操作是检验容量瓶是否漏水.
(4)在配制过程中,其他操作都是正确的,下列操作会引起所配溶液浓度偏高的是④⑤.
①洗涤烧杯和玻璃棒,并将洗涤液倒入水槽中
②转移溶液时不慎有少量洒到容量瓶外面
③容量瓶不干燥,含有少量蒸馏水
④定容时俯视刻度线
⑤未冷却到室温就将溶液转移到容量瓶并定容
⑥定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线
⑦若将氢氧化钠固体放纸上称量
(5)氢氧化钠溶液配好后应贮存在细口试剂瓶中,加盖橡胶塞.
分析 (1)配制240mL溶液,需要选用250mL容量瓶,根据实验操作的步骤对各操作进行排序,然后根据配制步骤以及每步操作需要仪器确定反应所需仪器;
(2)根据托盘天平的称量原理计算出烧杯的实际质量;根据m=nM=cVM计算需要氢氧化钠的质量;
(3)根据容量瓶的构造及正确使用方法进行判断;
(4)根据c=$\frac{n}{V}$可得,一定物质的量浓度溶液配制的误差都是由溶质的物质的量n和溶液的体积V引起的,误差分析时,关键要看配制过程中引起n和V怎样的变化:若n比理论值小,或V比理论值大时,都会使所配溶液浓度偏小;若n比理论值大,或V比理论值小时,都会使所配溶液浓度偏大;
(5)氢氧化钠溶液能够与玻璃塞中的二氧化硅反应,应该放在细口瓶、橡皮塞的试剂瓶中.
解答 解:(1)实验室中没有240mL的容量瓶,配制时需要选用250mL的容量瓶,配制250mL1.0mol/L的NaOH溶液的步骤为:计算→称量→溶解、冷却→移液→定容→摇匀→装瓶→贴签,一般用天平称量(用到药匙)称量,在烧杯中溶解,冷却后转移到250mL容量瓶中,并用玻璃棒引流,转移完毕,用少量蒸馏水洗涤烧杯及玻璃棒2~3次并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,使溶液的凹液面的最低点与刻线相平,塞好瓶塞,反复上下颠倒摇匀,所以正确的操作顺序为:②①③⑧⑤⑥⑦④;需要的仪器为:托盘天平、药匙、烧杯、玻璃棒、250mL容量瓶、胶头滴管,还缺少250mL容量瓶,
故答案为:②①③⑧⑤⑥⑦④;250ml容量瓶、胶头滴管;
(2)根据图示可知,游码的读数为2.6g,结合托盘天平的称量原理可知,图示中,砝码质量=烧杯质量+游码质量,所以烧杯质量=砝码质量-游码质量=20g+10g-2.6g=27.4g;配制250mL1.0mol/L的NaOH溶液,需要氢氧化钠的质量为:0.25L×1mol/L×40g/mol=10.0g,
故答案为:27.4;10.0;
(3)容量瓶有瓶塞,配制过程中需要摇匀,为了避免液体流出,配制溶液之前需要据此容量瓶是否漏水,
故答案为:检验容量瓶是否漏水;
(4)①洗涤烧杯和玻璃棒,并将洗涤液倒入水槽中,导致配制的溶液中溶质的物质的量偏小,配制的溶液浓度偏低,故①错误;
②转移溶液时不慎有少量洒到容量瓶外面,导致配制的溶液中溶质的物质的量偏小,溶液浓度偏低,故②错误;
③容量瓶不干燥,含有少量蒸馏水,对溶质的物质的量及溶液的最终体积都没有影响,不影响配制结果,故③错误;
④定容时俯视刻度线,导致加入的蒸馏水体积低于容量瓶刻度线,配制的溶液体积偏小,溶液浓度偏高,故④正确;
⑤未冷却到室温就将溶液转移到容量瓶并定容,热的溶液体积偏大,冷却后溶液体积变小,导致配制的溶液体积偏小,溶液浓度偏高,故⑤正确;
⑥定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线,导致配制的溶液体积偏大,溶液浓度偏低,故⑥错误;
⑦若将氢氧化钠固体放纸上称量,氢氧化钠容易潮解、变质,导致称量的氢氧化钠的质量偏小,配制的溶液中氢氧化钠的物质的量偏小,配制的溶液溶液浓度偏低,故⑦错误;
故答案为:④⑤;
(5)氢氧化钠溶液具有强腐蚀性,能够与二氧化硅反应,不能所以玻璃塞,所以储存氢氧化钠溶液的方法为:放在细口试剂瓶中,加盖橡胶塞,
故答案为:细口试剂瓶中,加盖橡胶塞.
点评 本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,属于基础型题目,难度不大.

| A. | 4g重水(D2O)中所含质子数为0.2×6.02×1023 | |
| B. | 2.8g乙烯和丙烯的混合气体中所含碳原子数为0.2×6.02×1023 | |
| C. | 4.48LH2和O2的混合气体中所含分子数为0.2×6.02×1023 | |
| D. | 0.2molCl2溶解于等体积的水中,转移电子数为0.2×6.02×1023 |
| A. | 常温常压下,1molCO2的体积是22.4L | |
| B. | 标准状况下1molH2O的体积为22.4L | |
| C. | 标准状况下2molO2的体积约为44.8L | |
| D. | 1molO2和1molN2的体积相等 |
| A | 实验室制氢气,为了加快反应速率,可向稀H2SO4中滴加少量Cu(NO3)2溶液 | |
| B | 为处理锅炉水垢中的CaSO4,可先用饱和Na2CO3溶液浸泡,再加入盐酸溶解 | |
| C | N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变时升高温度,平衡时氢气转化率增大 | |
| D | 吸热反应“TiO2(s)+2Cl 2(g)=TiCl4(g)+O2(g)”在一定条件下可自发进行, 则该反应的△S<0 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 2克16O2和14N2的混合气中含有的电子数为NA个 | |
| B. | 1molNa与O2完全反应生成Na2O和Na2O2的混合物,转移电子总数为NA个 | |
| C. | Na2O和Na2O2的混合物中若含有1molNa+,则其含有阴离子总数为0.5NA | |
| D. | 常温下,1.0L pH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA |
| A. | 胶体和溶液均能通过滤纸 | |
| B. | 胶体加入某些盐可产生沉淀,而溶液不能 | |
| C. | 胶体是一种介稳性的分散系,而溶液是一种非常稳定的分散系 | |
| D. | 胶体能够发生丁达尔现象,而溶液则不能 |
| A. | 标况下,混合气体的平均分子量可表示为22.4•混合气体的平均密度 | |
| B. | 1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA | |
| C. | 1.0L1mol/L的NaOH溶液中所含氧原子数为1NA | |
| D. | 常温常压下,14 g 由N2与CO组成的混合气体含有的原子数目为NA |
| A. |  | B. |  | C. |  | D. | 氢碘酸 |