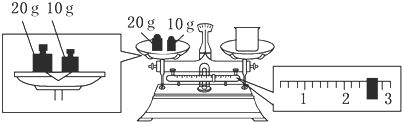
题目内容
3.下列叙述正确的是( )| A. | 常温常压下,1molCO2的体积是22.4L | |
| B. | 标准状况下1molH2O的体积为22.4L | |
| C. | 标准状况下2molO2的体积约为44.8L | |
| D. | 1molO2和1molN2的体积相等 |
分析 A、常温常压下,气体摩尔体积大于22.4L/mol;
B、标况下,水为液态;
C、标况下,气体摩尔体积为22.4L/mol,气体体积V=nVm来计算;
D、根据体积V=nVm来分析.
解答 解:A、常温常压下,气体摩尔体积大于22.4L/mol,故1mol二氧化碳的体积大于22.4L,故A错误;
B、标况下,水为液态,不能根据气体摩尔体积来计算其物质的量,故B错误;
C、标况下,气体摩尔体积为22.4L/mol,故2mol氧气的体积V=nVm=2mol×22.4L/mol=44.8L,故C正确;
D、根据体积V=nVm可知,气体的体积不但与物质的量有关,和气体摩尔体积的取值也有关,而氧气和氮气的状态不明确,不一定相等,故1mol氧气和1mol氮气的体积不一定相等,故D错误.
故选C.
点评 本题考查了气体摩尔体积的数值和其影响因素以及公式的使用条件,应注意的是气体摩尔体积的有关计算只使用于气体,且在标况下下为22.4L/mol.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
14. 往一体积不变的密闭容器中充入A2和B2,发生反应A2(g)+B2(g)?2C(g)△H>0;当达到平衡后,t0时若保持混合气体总物质的量不变而改变某一反应条件,使容器内压强增大.下列说法正确的是( )
往一体积不变的密闭容器中充入A2和B2,发生反应A2(g)+B2(g)?2C(g)△H>0;当达到平衡后,t0时若保持混合气体总物质的量不变而改变某一反应条件,使容器内压强增大.下列说法正确的是( )
 往一体积不变的密闭容器中充入A2和B2,发生反应A2(g)+B2(g)?2C(g)△H>0;当达到平衡后,t0时若保持混合气体总物质的量不变而改变某一反应条件,使容器内压强增大.下列说法正确的是( )
往一体积不变的密闭容器中充入A2和B2,发生反应A2(g)+B2(g)?2C(g)△H>0;当达到平衡后,t0时若保持混合气体总物质的量不变而改变某一反应条件,使容器内压强增大.下列说法正确的是( )| A. | 平衡向逆反应方向移动,平均相对分子质量不变 | |
| B. | 平衡向正反应方向移动,混合气体密度增大 | |
| C. | A2转化率增大,C平衡浓度变大 | |
| D. | t0时降低体系温度 |
8.下列有关化学用语的表示正确的是( )
| A. | 中子数为18的氯原子:${\;}_{17}^{35}$Cl | B. | 二氧化碳分子的比例模型: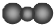 | ||
| C. | HClO的电子式: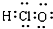 | D. | 对羟基苯甲醛的结构简式:OH- -CHO -CHO |
15.两个体积相同的容器,一个盛有NO,另一个盛有N2和O2(其物质的量之比为1:1),下列关于在同温同压下两容器内的气体的说法中不正确的是( )
| A. | 原子总数相同 | B. | 物质的量相同 | C. | 分子总数相同 | D. | 质量相同 |