题目内容
1.在下列溶液中,滴入FeCl3溶液,无变化的是( )| A. |  | B. |  | C. |  | D. | 氢碘酸 |
分析 FeCl3具有氧化性,可与还原性物质发生氧化还原反应,可与碱反应生成氢氧化铁沉淀,与酚类物质发生显色反应,以此解答该题.
解答 解:A.苯甲醇与FeCl3溶液不反应,故A正确;
B.对甲基苯酚加入FeCl3溶液,溶液显紫色,故B错误;
C.苯酚加入FeCl3溶液,溶液显紫色,故C错误;
D.铁离子可以氧化氢碘酸,生成碘单质和亚铁离子,故D错误;
故选A.
点评 本题综合考查了酚类物质的性质、铁离子的氧化性,侧重于学生的分析能力的考查,难度不大,注意酚类物质与三氯化铁形成了配合物,呈现出颜色.

练习册系列答案
相关题目
16.现有a mol丙烯和丙炔的混合气体通入足量的溴的四氯化碳溶液中,充分反应,最多消耗b mol Br2(a<b).则原混合气体中丙烯的体积分数为( )
| A. | $\frac{a-b}{a}$ | B. | $\frac{a}{a+b}$ | C. | $\frac{2a-b}{a}$ | D. | $\frac{2a-b}{b}$ |
6.下列物质属于酚类的是( )
| A. | 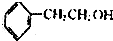 | B. |  | C. | 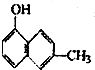 | D. |  |
2. 氢化钙(CaH2)是二种常用的储氢材料,也是登山运动员常用的能源提供剂,需要密封保存,遇水反应生成氢氧化钙和氢气.•某研究性学习小组模拟生产企业制取氢化钙
氢化钙(CaH2)是二种常用的储氢材料,也是登山运动员常用的能源提供剂,需要密封保存,遇水反应生成氢氧化钙和氢气.•某研究性学习小组模拟生产企业制取氢化钙
【实验】
用锌粒和稀硫酸反应制得干燥、纯净的氢气,再与金属钙在加热的条件下直接化合,即可制得CaH2.
(1)下列有关该实验的说法正确的是acd.
a其他条件相同时,粗锌制取氢气的速率比纯锌快
b•加热时,必须通人氮气作为保护气,以防止空气的干扰
c可以用浓硫酸或碱石灰对H2进行干燥除杂
d•开始实验时,应先通人H2,后给金属钙加热
已停止实验时,应先停止通人H2,后停止加热•
【提出假设】
(2)由于实验中操作不当,金属钙或氢化钙都可能被氧化;该小组甲同学对反应后的固体产物成分提出如下假设.
假设l:含有Ca 和CaH2.
假设2:含有CaH2和CaO.
假设3:含有Ca、CaH2、CaO.
【设计实验方案,验证假设】
(3)定性实验用化学方法鉴别Ca与CaH2,请设计实验完成下表中内容.
(4)定量实验 测定Ca 和CaH2混合物中CaH2 的质量分数.
①取m1g样品与水完全反应,利用如图装置测定生成的气体体积时,在a时进行收集(填字母)
a刚开始有气泡时
b气泡连续均匀时
c气体经过验纯后,再收集
②如果装置气密性良好,操作正确,乙同学认为:由于液体加入,导致气体的体积测定偏大,则计算出氢化钙的质量分数偏高(天“偏高”、“偏低”“无影响”)
【反思与交流】
(5)登山运动员常用氢化钙作为能源提供剂,与氢气相比,其优点是氢化钙是固体,携带方便.既然金属钙与水反应也能生成氢气,为什么还要讲金属钙制备成氢化钙呢?你的观点是等质量的钙与氢化钙中,氢化钙产生成氢气多.
 氢化钙(CaH2)是二种常用的储氢材料,也是登山运动员常用的能源提供剂,需要密封保存,遇水反应生成氢氧化钙和氢气.•某研究性学习小组模拟生产企业制取氢化钙
氢化钙(CaH2)是二种常用的储氢材料,也是登山运动员常用的能源提供剂,需要密封保存,遇水反应生成氢氧化钙和氢气.•某研究性学习小组模拟生产企业制取氢化钙【实验】
用锌粒和稀硫酸反应制得干燥、纯净的氢气,再与金属钙在加热的条件下直接化合,即可制得CaH2.
(1)下列有关该实验的说法正确的是acd.
a其他条件相同时,粗锌制取氢气的速率比纯锌快
b•加热时,必须通人氮气作为保护气,以防止空气的干扰
c可以用浓硫酸或碱石灰对H2进行干燥除杂
d•开始实验时,应先通人H2,后给金属钙加热
已停止实验时,应先停止通人H2,后停止加热•
【提出假设】
(2)由于实验中操作不当,金属钙或氢化钙都可能被氧化;该小组甲同学对反应后的固体产物成分提出如下假设.
假设l:含有Ca 和CaH2.
假设2:含有CaH2和CaO.
假设3:含有Ca、CaH2、CaO.
【设计实验方案,验证假设】
(3)定性实验用化学方法鉴别Ca与CaH2,请设计实验完成下表中内容.
| 实验步骤(不要求写具体操作过程) | 预期现象和结论 |
| 取少量固体样品,•… |
①取m1g样品与水完全反应,利用如图装置测定生成的气体体积时,在a时进行收集(填字母)
a刚开始有气泡时
b气泡连续均匀时
c气体经过验纯后,再收集
②如果装置气密性良好,操作正确,乙同学认为:由于液体加入,导致气体的体积测定偏大,则计算出氢化钙的质量分数偏高(天“偏高”、“偏低”“无影响”)
【反思与交流】
(5)登山运动员常用氢化钙作为能源提供剂,与氢气相比,其优点是氢化钙是固体,携带方便.既然金属钙与水反应也能生成氢气,为什么还要讲金属钙制备成氢化钙呢?你的观点是等质量的钙与氢化钙中,氢化钙产生成氢气多.
3.用NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A. | 常温常压下,Na2O2与足量H2O反应,共生成0.2molO2,转移电子的数目为0.8NA | |
| B. | 25℃,pH=13的NaOH溶液中含有OH-的数目为0.1NA | |
| C. | 1mol甲基(-14C1H3)所含的中子数和电子数分别为8NA、9NA | |
| D. | 含4molHCl的浓盐酸与足量的二氧化锰在加热条件下反应,一定能产生NA个Cl2气体分子 |