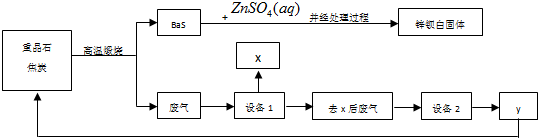
题目内容
10.已知H2O2是一种弱酸,在强碱溶液中主要以HO2-形式存在.现以Al-H2O2燃料电池电解尿素[CO(NH2)2]的碱性溶液制备氢气 (电解池中隔膜仅阻止气体通过,c、d均为惰性电极).下来说法正确的是 ( )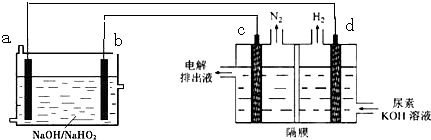
| A. | 燃料电池总的离子反应方程式为:2Al+3HO2-═2AlO2-+2H2O | |
| B. | 电解时,Al消耗2.7g,则产生氮气的体积为1.12L | |
| C. | 电极b是负极,且反应后该电极区pH增大 | |
| D. | 电解过程中,电子的流向由a→d,c→b. |
分析 电解时,电池反应时中,氮元素化合价由-3价变为0价,H元素化合价由+1价变为0价,所以生成氮气的电极是阳极,生成氢气的电极是阴极,则a是负极、b为正极,
H2O2-Al燃料电池工作时,Al为负极被氧化,H2O2为正极被还原,以此解答该题.
解答 解:A.H2O2-Al电池中电解池溶液呈碱性,HO2-被还原生成水,Al被氧化生成AlO2-,电池总反应为3HO2-+2Al=OH-+2AlO2-+H2O,故A错误;
B.每消耗2.7g Al,则转移0.3mol电子,电解池阳极中氮元素化合价由-3价变为0价,在可生成0.05mol氮气,理论上产生气体体积为1.12L(标准状况下),故B错误;
C.c生成氮气,说明尿素被氧化,则b为正极,正极方程式为3HO2-+6e-+3H2O=9OH-,反应后该电极区pH增大,故C错误;
D.电子从原电池负极→电解池阴极,从电解池阳极→原电池正极,即a→d,c→b,故D正确;
故选D.
点评 本题综合考查原电池以及电解原理,为高频考点,侧重于学生的分析能力的考查,明确元素化合价变化是解本题关键,根据元素化合价变化与阴阳极的关系来分析解答,难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
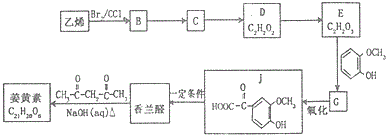
20.药物贝诺酯可由乙酰水杨酸和对乙酰氨基酚在一定条件下反应制得:

下列有关叙述正确的是( )

下列有关叙述正确的是( )
| A. | 贝诺酯与足量NaOH 溶液共热,最终生成乙酰水杨酸钠和对乙酰氨基酚钠 | |
| B. | 可用FeCl3 溶液区别乙酰水杨酸和对乙酰氨基酚 | |
| C. | 乙酰水杨酸和对乙酰氨基酚均能与NaHCO3 溶液反应 | |
| D. | 对乙酰氨基酚分子中核磁共振氢谱出现五组峰,且峰面积之比为3:1:2:2:1 |
1.下列说法中错误的是( )
| A. | 煤中含有苯及苯的同系物,可以通过干馏得到 | |
| B. | 煤是由有机物和无机物组成的复杂的混合物 | |
| C. | 含C18以上的烷烃经过催化裂化可以得到汽油 | |
| D. | 石油含有C5~C11的烷烃,可通过分馏得到汽油 |
2.有A、B、C、D四种短周期元素,其简单离子A+、B2+、C-、D2-的电子层结构相同.则下列比较中正确的是( )
| A. | 原子序数:A>B>C>D | B. | 离子半径:A+>B2+>C->D2- | ||
| C. | 氢化物稳定性:H2D>HC | D. | 金属性:A>B |
19.研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl═Na2Mn5O+2AgCl下列“水”电池在海水中放电时的有关说法正确的是( )
| A. | AgCl是还原产物 | |
| B. | 正极反应式:Ag+Cl--e-=AgCl | |
| C. | 每生成1molNa2Mn5O10转移2 mol电子 | |
| D. | Na+不断向“水”电池的负极移动 |

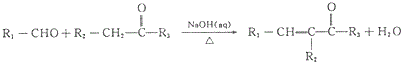 (R1、R2、R3为烃基或氢原子)
(R1、R2、R3为烃基或氢原子)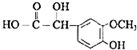 .
.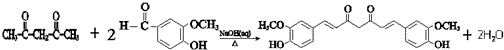 .
.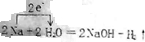 (直接标在答题卡的相应方程式上).
(直接标在答题卡的相应方程式上).