题目内容
20.药物贝诺酯可由乙酰水杨酸和对乙酰氨基酚在一定条件下反应制得:
下列有关叙述正确的是( )
| A. | 贝诺酯与足量NaOH 溶液共热,最终生成乙酰水杨酸钠和对乙酰氨基酚钠 | |
| B. | 可用FeCl3 溶液区别乙酰水杨酸和对乙酰氨基酚 | |
| C. | 乙酰水杨酸和对乙酰氨基酚均能与NaHCO3 溶液反应 | |
| D. | 对乙酰氨基酚分子中核磁共振氢谱出现五组峰,且峰面积之比为3:1:2:2:1 |
分析 A.乙酰水杨酸含有酯基,可在碱性条件下水解;
B.对乙酰氨基酚含有酚羟基,可与氯化铁发生显色反应;
C.酚羟基酸性较弱,与碳酸氢钠不反应;
D.分子中含有5种位置不同的H.
解答 解:A.乙酰水杨酸含有酯基,可在碱性条件下水解,贝诺酯与足量NaOH溶液共热发生水解,-COOC-、-NH-CO-均发生断键,不生成乙酰水杨酸钠和对乙酰氨基酚钠,故A错误;
B.对乙酰氨基酚含有酚羟基,可与氯化铁发生显色反应,可用FeCl3 溶液区别乙酰水杨酸和对乙酰氨基酚,故B正确;
C.酚羟基酸性较弱,与碳酸氢钠不反应,故C错误;
D.分子中含有5种位置不同的H,由结构可知峰面积之比为3:1:2:2:1,故D正确.
故选BD.
点评 本题考查有机物的结构和性质,为高频考点,明确酚及酯的性质是解答本题的关键,注意选项A中的水解为解答的难点和易错点,题目难度中等.

练习册系列答案
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案
相关题目
4.日常生活中经常用到的下列物质中,属于纯净物的是( )
| A. | 调味用的食醋 | B. | 餐饮用的啤酒 | ||
| C. | 用蒸馏水制得的降温用的冰块 | D. | 炒菜用的铁锅 |
11.下列有关有机物的性质和应用正确的是( )
| A. | 天然气、石油都是清洁的可再生能源 | |
| B. | 乙烯和1,3-丁二烯互为同系物,它们均能使Br2水褪色 | |
| C. | 苯、乙醇和乙酸都能发生取代反应 | |
| D. | 石油的分馏可获得乙烯、丙烯等不饱和烃 |
15.下列叙述中,错误的是( )
| A. | 苯与浓硝酸、浓硫酸共热并保持55~60℃反应生成硝基苯 | |
| B. | 苯乙烯在合适条件下催化加氢可生成乙基环己烷 | |
| C. | 乙烯与溴的四氯化碳溶液反应生成1,2-二溴乙烷 | |
| D. | 甲苯与氯气在光照下反应主要生成2-氯甲苯 |
12.在一定条件下能够发生水解反应,且水解的最终产物只有一种的是( )
| A. | 淀粉 | B. | 蚕丝 | C. | 豆油 | D. | 聚丙烯酸甲酯 |
9.向一定量Fe3O4和Fe的混合物中加入50mL2mol•L-1H2SO4溶液,恰好使混合物完全溶解,放出448mL(标准状况下)的气体.向所得溶液中加入KSCN溶液,无红色出现.则用足量的CO在高温下与相同质量的此混合物充分反应,能得到铁的质量为( )
| A. | 2.8g | B. | 5.6g | C. | 11.2g | D. | 22.4g |
10.已知H2O2是一种弱酸,在强碱溶液中主要以HO2-形式存在.现以Al-H2O2燃料电池电解尿素[CO(NH2)2]的碱性溶液制备氢气 (电解池中隔膜仅阻止气体通过,c、d均为惰性电极).下来说法正确的是 ( )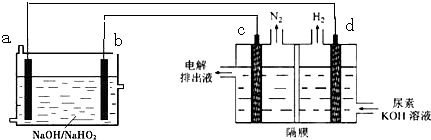

| A. | 燃料电池总的离子反应方程式为:2Al+3HO2-═2AlO2-+2H2O | |
| B. | 电解时,Al消耗2.7g,则产生氮气的体积为1.12L | |
| C. | 电极b是负极,且反应后该电极区pH增大 | |
| D. | 电解过程中,电子的流向由a→d,c→b. |

 .
.