题目内容
5.在钠和水的反应中:2Na+2H2O═2NaOH+H2↑,氧化剂是H2O(填化学式),还原产物是氢气(填名称).该反应中,若消耗了2mol Na,转移的电子数为2NA.试用“单线桥”标出电子的转移方向和数目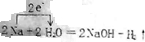 (直接标在答题卡的相应方程式上).
(直接标在答题卡的相应方程式上).
分析 2Na+2H2O═2NaOH+H2↑中,Na元素的化合价由0升高为+1价,水中H元素的化合价由+1价降低为0,以此来解答.
解答 解:2Na+2H2O═2NaOH+H2↑中,Na元素的化合价由0升高为+1价,水中H元素的化合价由+1价降低为0,该反应中转移2e-,用“单线桥”标出电子的转移方向和数目为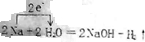 ,则氧化剂为H2O,得到电子被还原,对应还原产物为氢气,该反应中,若消耗了2mol Na,转移的电子数为2mol×(1-0)×NA=2NA,
,则氧化剂为H2O,得到电子被还原,对应还原产物为氢气,该反应中,若消耗了2mol Na,转移的电子数为2mol×(1-0)×NA=2NA,
故答案为:H2O;氢气;2NA;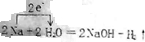 .
.
点评 本题考查氧化还原反应,为高频考点,把握发生的反应及反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
15.下列叙述中,错误的是( )
| A. | 苯与浓硝酸、浓硫酸共热并保持55~60℃反应生成硝基苯 | |
| B. | 苯乙烯在合适条件下催化加氢可生成乙基环己烷 | |
| C. | 乙烯与溴的四氯化碳溶液反应生成1,2-二溴乙烷 | |
| D. | 甲苯与氯气在光照下反应主要生成2-氯甲苯 |
16.25℃时,浓度均为0.2mol/L的NaHCO3和Na2CO3溶液中,下列判断不正确的是( )
| A. | 均存在电离平衡和水解平衡 | |
| B. | 分别加入NaOH固体,恢复至原温,c(CO32-)均增大 | |
| C. | c(OH-)前者大于后者 | |
| D. | 存在的粒子种类相同 |
13. 能源的发展日益成为全世界、全人类共同关心的问题.
能源的发展日益成为全世界、全人类共同关心的问题.
(1)A和B的单质单位质量的燃烧热大,可用作燃料.已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
①请根据上述信息,写出A基态原子的核外电子排布式:1s22s2.
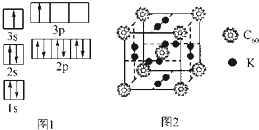
②某同学根据上述信息,推断B的核外电子排布如图1所示,该同学所画的电子排布图违背了能量最低原理.
(2)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料.
①已知金刚石中C-C键的键长为154.45pm,C60中C-C键的键长为145pm和140pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确并阐述理由不正确,C60是分子晶体,熔化时不需破坏化学键.
②科学家把C60和K掺杂在一起制造了一种富勒烯化合物,其晶胞如图2所示,该物质在低温时是一种超导体.该物质中K原子和C60分子的个数比为3:1.
③继C60后,科学家又合成Si60、N60,C、Si、N原子电负性由大到小的顺序是N>C>Si.Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为30.
 能源的发展日益成为全世界、全人类共同关心的问题.
能源的发展日益成为全世界、全人类共同关心的问题.(1)A和B的单质单位质量的燃烧热大,可用作燃料.已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| A | 899 | 1 757 | 14 840 | 21 000 |
| B | 738 | 1 451 | 7 733 | 10 540 |
②某同学根据上述信息,推断B的核外电子排布如图1所示,该同学所画的电子排布图违背了能量最低原理.
(2)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料.
①已知金刚石中C-C键的键长为154.45pm,C60中C-C键的键长为145pm和140pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确并阐述理由不正确,C60是分子晶体,熔化时不需破坏化学键.
②科学家把C60和K掺杂在一起制造了一种富勒烯化合物,其晶胞如图2所示,该物质在低温时是一种超导体.该物质中K原子和C60分子的个数比为3:1.
③继C60后,科学家又合成Si60、N60,C、Si、N原子电负性由大到小的顺序是N>C>Si.Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为30.
20.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 44gCO2 的体积为22.4L | |
| B. | 标准状况下,22.4L水中含有NA个水分子 | |
| C. | 常温常压下,28gN2中所含的原子数目为2NA | |
| D. | 如果11.2LN2中含有n个氮气分子,则阿佛加德罗常数一定为2n |
10.已知H2O2是一种弱酸,在强碱溶液中主要以HO2-形式存在.现以Al-H2O2燃料电池电解尿素[CO(NH2)2]的碱性溶液制备氢气 (电解池中隔膜仅阻止气体通过,c、d均为惰性电极).下来说法正确的是 ( )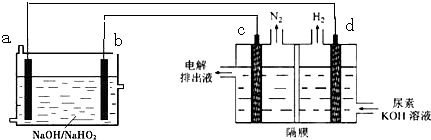

| A. | 燃料电池总的离子反应方程式为:2Al+3HO2-═2AlO2-+2H2O | |
| B. | 电解时,Al消耗2.7g,则产生氮气的体积为1.12L | |
| C. | 电极b是负极,且反应后该电极区pH增大 | |
| D. | 电解过程中,电子的流向由a→d,c→b. |
17.用NA表示阿伏加德罗常数的数值.下列说法正确的是( )
| A. | 在O2参与的反应中,1 mol O2作氧化剂时得到的电子数一定是4NA | |
| B. | 1 L 1 mol•L-1 NH4NO3溶液中氮原子数小于2NA | |
| C. | 常温常压下,11.2 g乙烯中含有共用电子对数目为2.4NA | |
| D. | 标准状况下,22.4 L CHCl3中所含有的分子数为NA |
14.某物质的结构简式如图,关于该物质的下列说法中正确的是( )
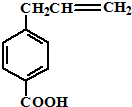

| A. | 该化合物的化学式为C10H11O2 | |
| B. | 分子中所有的碳原子不可能处于同一平面上 | |
| C. | 它的部分同分异构体能发生水解反应时则不能发生消去反应 | |
| D. | 该化合物能与新制的Cu(OH)2溶液发生反应生成砖红色沉淀且苯环上的一氯代物只有一种的同分异构体有4 |
12.已知反应A2(g)+2B2(g)?2AB2(g)的△H<0,下列说法正确的是( )
| A. | 达到平衡后,增大压强有利于该反应平衡正向移动 | |
| B. | 达到化学平衡时,v正(A2)=2v逆(B2) | |
| C. | 升高温度,正向反应速率增加,逆向反应速率减小 | |
| D. | 达到平衡后,降低温度A2 气体的转化率减小 |