题目内容
2.有A、B、C、D四种短周期元素,其简单离子A+、B2+、C-、D2-的电子层结构相同.则下列比较中正确的是( )| A. | 原子序数:A>B>C>D | B. | 离子半径:A+>B2+>C->D2- | ||
| C. | 氢化物稳定性:H2D>HC | D. | 金属性:A>B |
分析 四种短周期元素简单离子A+、B2+、C-、D2-的电子层结构相同,离子只能有2个电子层,结合离子所带电荷可知:A为Na、B为Mg、C为F、D为O.
A.根据具体元素判断原子序数;
B.电子层结构相同的离子,核电荷数越大离子半径越小;
C.非金属性越强,对应氢化物越稳定;
D.同周期自左而右金属性增强.
解答 解:四种短周期元素简单离子A+、B2+、C-、D2-的电子层结构相同,离子只能有2个电子层,结合离子所带电荷可知:A为Na、B为Mg、C为F、D为O.
A.A为Na、B为Mg、C为F、D为O,故原子序数:B>A>C>D,故A错误;
B.电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:D2->C->A+>B2+,故B错误;
C.非金属F>O,非金属性越强,对应氢化物越稳定,故氢化物稳定性:H2O<HF,故C错误;
D.同周期自左而右金属性增强,故金属性:Na>Mg,故D正确,
故选:D.
点评 本题考查原子结构与元素周期律等,难度不大,可以确定元素的相对位置进行解答,难度不大.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
12.在一定条件下能够发生水解反应,且水解的最终产物只有一种的是( )
| A. | 淀粉 | B. | 蚕丝 | C. | 豆油 | D. | 聚丙烯酸甲酯 |
13.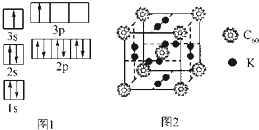 能源的发展日益成为全世界、全人类共同关心的问题.
能源的发展日益成为全世界、全人类共同关心的问题.
(1)A和B的单质单位质量的燃烧热大,可用作燃料.已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
①请根据上述信息,写出A基态原子的核外电子排布式:1s22s2.
②某同学根据上述信息,推断B的核外电子排布如图1所示,该同学所画的电子排布图违背了能量最低原理.
(2)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料.
①已知金刚石中C-C键的键长为154.45pm,C60中C-C键的键长为145pm和140pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确并阐述理由不正确,C60是分子晶体,熔化时不需破坏化学键.
②科学家把C60和K掺杂在一起制造了一种富勒烯化合物,其晶胞如图2所示,该物质在低温时是一种超导体.该物质中K原子和C60分子的个数比为3:1.
③继C60后,科学家又合成Si60、N60,C、Si、N原子电负性由大到小的顺序是N>C>Si.Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为30.
 能源的发展日益成为全世界、全人类共同关心的问题.
能源的发展日益成为全世界、全人类共同关心的问题.(1)A和B的单质单位质量的燃烧热大,可用作燃料.已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| A | 899 | 1 757 | 14 840 | 21 000 |
| B | 738 | 1 451 | 7 733 | 10 540 |
②某同学根据上述信息,推断B的核外电子排布如图1所示,该同学所画的电子排布图违背了能量最低原理.
(2)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料.
①已知金刚石中C-C键的键长为154.45pm,C60中C-C键的键长为145pm和140pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确并阐述理由不正确,C60是分子晶体,熔化时不需破坏化学键.
②科学家把C60和K掺杂在一起制造了一种富勒烯化合物,其晶胞如图2所示,该物质在低温时是一种超导体.该物质中K原子和C60分子的个数比为3:1.
③继C60后,科学家又合成Si60、N60,C、Si、N原子电负性由大到小的顺序是N>C>Si.Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为30.
10.已知H2O2是一种弱酸,在强碱溶液中主要以HO2-形式存在.现以Al-H2O2燃料电池电解尿素[CO(NH2)2]的碱性溶液制备氢气 (电解池中隔膜仅阻止气体通过,c、d均为惰性电极).下来说法正确的是 ( )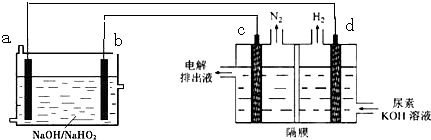

| A. | 燃料电池总的离子反应方程式为:2Al+3HO2-═2AlO2-+2H2O | |
| B. | 电解时,Al消耗2.7g,则产生氮气的体积为1.12L | |
| C. | 电极b是负极,且反应后该电极区pH增大 | |
| D. | 电解过程中,电子的流向由a→d,c→b. |
17.用NA表示阿伏加德罗常数的数值.下列说法正确的是( )
| A. | 在O2参与的反应中,1 mol O2作氧化剂时得到的电子数一定是4NA | |
| B. | 1 L 1 mol•L-1 NH4NO3溶液中氮原子数小于2NA | |
| C. | 常温常压下,11.2 g乙烯中含有共用电子对数目为2.4NA | |
| D. | 标准状况下,22.4 L CHCl3中所含有的分子数为NA |
14.某物质的结构简式如图,关于该物质的下列说法中正确的是( )
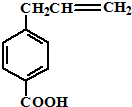

| A. | 该化合物的化学式为C10H11O2 | |
| B. | 分子中所有的碳原子不可能处于同一平面上 | |
| C. | 它的部分同分异构体能发生水解反应时则不能发生消去反应 | |
| D. | 该化合物能与新制的Cu(OH)2溶液发生反应生成砖红色沉淀且苯环上的一氯代物只有一种的同分异构体有4 |
11.选择正确答案的序号,填入下表空格中.
A、同位素 B、同分异构体 C、同系物 D、同素异形体 E、同一物质 F、同类物质
A、同位素 B、同分异构体 C、同系物 D、同素异形体 E、同一物质 F、同类物质
| 物质名称 | 相互关系 | 物质名称 | 相互关系 |
| ①氯仿与三氯甲烷 | ④氕、氘、氚 | ||
| ②一氯甲烷与四氯化碳 | ⑤白磷与红磷 | ||
| ③乙烷与新戊烷 | ⑥正丁烷与异丁烷 |
