��Ŀ����
����Ŀ���ۺ���������PFS����һ�ָ�Ч�����߷�����������ij�������þ���ѡ����������������Ч�ɷ�Ϊ Fe2O3 �� Fe3O4���Ʊ� PFS���乤����������ͼ��ʾ��
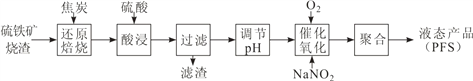
��1��CO�ǡ���ԭ���ա����̵���Ҫ��ԭ������ͼ�У����߱�ʾ 4 ����ѧ��Ӧ a��b��c��d �ﵽƽ��ʱ������ɺ��¶ȵĹ�ϵ�����ֱ��� Fe2O3��Fe3O4��FeO��Fe �ȶ����ڵ�����a����__________������ȷ�Ӧ�����ȷ�Ӧ������570��ʱ��d ��Ӧ��ƽ�ⳣ�� K=___________________��
��2��800�棬���������CO2���������Ϊ40��ʱ��Fe2O3��CO��ԭ���չ����з�������Ҫ�Ļ�ѧ��Ӧ����ʽ��________________________________________________
��3�����������ʱ�����������Һ Fe2+�����������ͣ���Ҫԭ����___________________��
��4����֪��25��ʱ��Ksp[Fe(OH)2]=1.0��10-17��Ksp[Fe(OH)3]=1.0��10-39��������Һ��c(Fe3+) = 10-1.8mol��L-1��Ϊ���⡰�������������в��������� Fe(OH)3��Ӧ���ڽ���Һ�� pH��___________��
��5��FeSO4 ��Һ�ڿ����лỺ�������������ܵ�Fe(OH)SO4 ���÷�Ӧ�����ӷ���ʽ_____________________________________.
��6�����������������У��� NaNO2 ��������NO ��ʵ���ϵĴ����ã�ʱ���¶���Fe2+ת���ʵĹ�ϵ����ͼ��ʾ����Ӧʱ����ͬ����Fe2+ ת�������¶ȵ��������������½���ԭ����___________________________________________.
���𰸡� ���ȷ�Ӧ 1 Fe2O3+CO=FeO+CO2 Fe2+�ױ������е� O2 ������ Fe3+ 1.6 4Fe2++O2+4SO42-+2H2O=4Fe(OH)SO4�� �¶����ߣ���Ӧ���������¶ȹ��ߣ�NO �����ݳ���ת�����½�
����������1��a���������¶ȵ����ߣ�CO�İٷֺ�������ƽ�������ƶ�����a���ڷ��ȷ�Ӧ��570��ʱ��һ����̼�Ͷ�����̼�ٷֺ����������Ũ�������d��Ӧ��ƽ�ⳣ��![]() ����ȷ�������ȷ�Ӧ�� 1��
����ȷ�������ȷ�Ӧ�� 1��
��2������ͼ���֪��800�棬���������CO2���������Ϊ40��ʱ��Fe2O3��CO��ԭ���չ����з�������Ҫ�Ļ�ѧ��Ӧ����ʽ��Fe2O3+CO=FeO+CO2 ����ȷ����Fe2O3+CO=FeO+CO2 ��
��3�����������ʱ�����������Һ�� Fe2+�����������ͣ���Ҫԭ���ǣ� Fe2+�ױ������е�O2 ������ Fe3+�������������𰸣�����ȷ�𰸣�Fe2+�ױ������е� O2 ������ Fe3+ �������������𰸣���
��4��![]() ��c(OH-)=10-12.4mol/L��c(H+)=10-1.6mol/L��Ӧ���ڽ���Һ��
��c(OH-)=10-12.4mol/L��c(H+)=10-1.6mol/L��Ӧ���ڽ���Һ��![]() ����ȷ�𰸣�1.6��
����ȷ�𰸣�1.6��
��5��FeSO4 ��+2�����ڿ����лᱻ��������Ϊ+3�������������ܵ�Fe(OH)SO4����Ӧ�����ӷ���ʽ4Fe2++O2+4SO42-+2H2O=4Fe(OH)SO4������ȷ����4Fe2++O2+4SO42-+2H2O=4Fe(OH)SO4����
��6������ͼ���֪��70��Ϊ����¶ȣ�Fe2+ת�������¶ȵ��������������½���ԭ���ǣ��¶����ߣ���Ӧ���������¶ȹ��ߣ�NO �����ݳ���ת�����½�����ȷ�𰸣��¶����ߣ���Ӧ���������¶ȹ��ߣ�NO �����ݳ���ת�����½���

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ����ij��Br����ˮ����ȡBr2�Ĺ��̰��������ˡ���������ȡ����ѡ�������ȡ����������Ȳ��衣��֪��
���� | Br2 | CCl4 | ��ʮ���� |
�ܶ�/g��cm-3 | 3.119 | 1.595 | 0.753 |
�е�/�� | 58.76 | 76.8 | 215~217 |
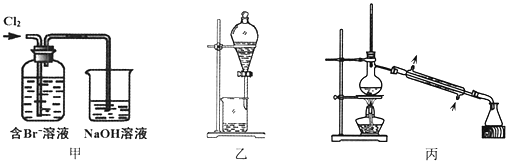
����˵������ȷ����
A. ��װ����Br�������ķ�ӦΪ��2Br-+ Cl2 = Br2 + 2Cl-
B. ��װ����NaOH��Һÿ����0.1mol Cl2��ת��0.1mol e��
C. ����װ�ý�����ȡ���ܽ�Br2���л������²�
D. �ñ�װ�ý����������ռ�������Br2
����Ŀ���о���Ԫ�ؼ��仯��������ʾ�����Ҫ���塣
(1)25 �棬��0.10 mol��L��1H2S��Һ�У�ͨ��HCl��������NaOH�����Ե�����ҺpH����ҺpH��c(S2��)��ϵ����ͼ(������Һ����ı仯��H2S�Ļӷ�)��

��pH��11ʱ����Һ�е�c(H2S)��c(HS��)��________mol��L��1��
��ij��Һ��0.020 mol��L��1Mn2����0.10 mol��L��1H2S������ҺpH��________ʱ��Mn2����ʼ������[��֪��Ksp(MnS)��2.8��10��13]
(2)25 �棬������ĵ��볣�����±���
Ka1 | Ka2 | |
H2SO3 | 1.3��10��2 | 6.3��10��8 |
H2CO3 | 4.2��10��7 | 5.6��10��11 |
��HCO![]() �ĵ��볣������ʽK��________��
�ĵ��볣������ʽK��________��
��0.10 mol��L��1Na2SO3��Һ������Ũ���ɴ�С��˳��Ϊ___________________��
��H2SO3��Һ��NaHCO3��Һ��Ӧ����Ҫ���ӷ���ʽΪ__________________________��
����Ŀ��(2018������ʡ�Ϸ��и��������ν�ѧ�������)H2S���ؽ������Ӵ�����ú��������������ҪӦ�á���ش�
����H2S��ú����ԭ����������̵���Ҫ�м��壬��Ӧԭ��Ϊ
����COS(g)+H2(g)![]() H2S(g)+CO(g)��H=+7kJ��mol1
H2S(g)+CO(g)��H=+7kJ��mol1
����CO(g)+H2O(g)![]() CO2(g)+H2(g)��H=42kJ��mol1
CO2(g)+H2(g)��H=42kJ��mol1
��֪����1mol��̬�����еĻ�ѧ�������������±���ʾ��
���� | COS(g) | H2(g) | CO(g) | H2S(g) |
����(kJ��mol1) | 1310 | 442 | x | 669 |
��1���������x=_______��
��2��T��ʱ����VL�ݻ�������ܱ������г���1mol COS(g)��1mol H2(g)��1mol H2O(g)����������������Ӧ��
����T��ʱ���ƽ����ϵ��COSΪ0.80 mol��H2Ϊ0.85 mol����T��ʱ��Ӧ����ƽ�ⳣ��K=_______(����2λ��Ч����)��
��������Ӧ��ƽ������������ٳ���1mol COS(g)��1molH2(g)��1mol H2O(g)�����ٴδ�ƽ���H2���������_______(����������������С������������);�������¶ȣ���CO��ƽ���������_______(����������������С������������)����������_______��
����H2S�ڸ����·ֽ���ȡH2��ͬʱ������������
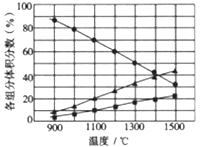
��3����2L�ܱ������м���0.2molH2S����Ӧ�ڲ�ͬ�¶�(900~1500��)�´ﵽƽ��ʱ����������и���ֵ������������ͼ��ʾ�����ڴ��¶������ڣ�H2S�ֽⷴӦ����Ҫ��ѧ����ʽΪ_______����1300��ʱ����Ӧ��2min�ﵽƽ�⣬��0��2min�ķ�Ӧ����v(H2S)=_______��
����H2S�����ؽ������ӵij�������
��4��25��ʱ����Ũ�Ⱦ�Ϊ0.001mol��L1Sn2+��Ag+�Ļ����Һ��ͨ��H2S����Sn2+��ʼ����ʱ����Һ��c(Ag+)=_______��(��֪��25��ʱ��Ksp(SnS)=1.0��1025��Ksp(Ag2S)=1.6��1049)��
