题目内容
【题目】Ⅰ已知铜在常温下能被HNO3溶解。反应方程式为: 3Cu+8HNO3=3Cu(NO3)2+2NO ↑+4H2O
(1)请将上述反应改成离子方程式,并用单线桥法表示电子得失的方向和数目________________。
(2)若生成448mL的NO(标准状况下),则该过程中转移的电子是___________mol。
(3)被还原的硝酸占参加反应硝酸的比例为___________。
Ⅱ某反应体系有反应物和生成物共7种物质:C、H2SO4、K2CrO4、K2SO4、CO2 、Cr2(SO4)3和H2O。已知该反应中发生如下过程:C→CO2。该反应的化学方程式:__________________________。
【答案】![]() 0.06
0.06 ![]() 3C + 10H2SO4 + 4K2CrO4 = 4K2SO4 + 2Cr2(SO4) 3 + 3CO2↑+ 10H2O
3C + 10H2SO4 + 4K2CrO4 = 4K2SO4 + 2Cr2(SO4) 3 + 3CO2↑+ 10H2O
【解析】
(1)硝酸、硝酸铜能拆成离子形式,据此写出该反应离子方程;该反应中铜把电子转移给了硝酸根中氮原子,共转移6e-,用单线桥表示电子转移的防向和数目;
(2)根据反应关系6e----2NO,进行计算;
(3) 由C→CO2可以知道,反应中C为还原剂,CO2为氧化产物,则K2CrO4为氧化剂,对应产物Cr2(SO4)3为还原产物;结合氧化还原反应得失电子守恒及原子个数守恒书写方程式。
(1) 反应方程式为: 3Cu+8HNO3=3Cu(NO3)2+2NO ↑+4H2O;硝酸、硝酸铜均拆成离子形式,剩余物质均不拆,离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;该反应中铜元素化合价升高,共失电子6e-,根据电子得失守恒规律,硝酸根离子中氮原子得到6e-,单线桥法表示该反应电子得失的方向和数目如下:![]() ;综上所述,本题答案是:
;综上所述,本题答案是:![]() 。
。
(2)根据反应关系可知,6e----2NO,448mLNO的物质的量为0.02mol,则该过程中转移的电子0.06 mol;综上所述,本题答案是:0.06。
(3)根据反应可知,8mol HNO3参加反应,被还原的硝酸有2 mol,所以被还原的硝酸占参加反应硝酸的比例为2/8=1/4;综上所述,本题答案是:1/4。
Ⅱ根据题意:C→CO2,反应中C为还原剂,CO2为氧化产物,则K2CrO4为氧化剂,对应产物Cr2(SO4)3为还原产物;C→CO2化合价升高4,2K2CrO4→Cr2(SO4)3化合价共降6,根据得失电子守恒,C系数为3,CO2系数为3, Cr2(SO4)3系数为2,则K2CrO4系数为4,根据原子个数守恒, K2SO4系数为4,H2SO4系数为10,H2O的系数为10,具体为:3C + 10H2SO4 + 4K2CrO4 = 4K2SO4 + 2Cr2(SO4) 3 + 3CO2↑+ 10H2O;综上所述,本题答案是:3C + 10H2SO4 + 4K2CrO4 = 4K2SO4 + 2Cr2(SO4) 3 + 3CO2↑+ 10H2O。

【题目】磷和砷的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)基态As原子的核外电子排布式为[Ar]_________;As原子的逐级电离能(kJ/mol)数据如下:
第一电离能 | 第二电离能 | 第三电离能 | 第四电离能 | 第五电离能 | 第六电离能 |
947.0 | 1798 | 2735 | 4837 | 6043 | 12310 |
第五电离能与第六电离能相差显著的原因:_____________________________________。
(2)红磷是巨型共价分子,无定型结构。能证明红磷是非晶体的最可靠方法是__________。
A.质谱 B.原子发射光谱 C.核磁共振谱 D.X射线衍射
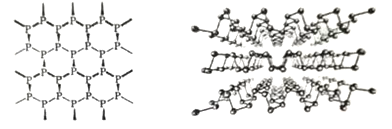
(3)黑磷是新型二维半导体材料,具有类似石墨一样的片层结构(如图),层与层之间以_____结合。从结构上看,单层磷烯导电性优于石墨烯的原因是____________________________。
(4)白磷(P4)分子是正四面体结构,3.1g白磷中σ键的数目为________;白磷(P4)易溶于二硫化碳,难溶于水,其原因是_____________________________________________。
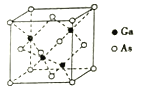
(5)GaAs的熔点为1238℃,其晶胞结构如图所示。该晶体的类型为_________,Ga原子的杂化方式为______________,每个As原子周围最近的As原子数目为________。已知GaAs的密度为dg/cm3,摩尔质量为Mg/mol,则晶胞中最近的As和Ga原子核间距为_____(阿伏加德罗常数值用NA表示,列出算式即可)nm。