题目内容
10.判断正误:(1)电离平衡常数可以表示弱电解质电离的相对强弱.( )
(2)醋酸在醋酸钠溶液中电离的程度大于在纯水中电离的程度.( )
(3)一定温度下,醋酸的浓度越大,其电离程度越大.( )
(4)H2CO3的电离常数表达式Ks=$\frac{c({H}^{+})•c(C{{O}_{3}}^{2-})}{c({H}_{2}C{O}_{3})}$.( )
(5)一定温度下,CH3COOH浓度越大,电离常数越大.( )
分析 (1)一般来讲,电离平衡常数越大,则电离程度越大,电离平衡常数表示弱电解质电离的相对强弱;
(2)醋酸钠电离出的醋酸根离子抑制了醋酸的电离;
(3)醋酸为弱电解质,醋酸的浓度越大,醋酸的电离程度越小;
(4)碳酸为二元弱酸,其电离平衡常数需要分步书写;
(5)电离平衡常数只与温度有关.
解答 解:(1)电离平衡常数可以表示弱电解质的相对强弱,故该说法正确,
故答案为:正确;
(2)醋酸钠溶液中,醋酸根离子抑制了醋酸的电离,则醋酸中醋酸钠溶液中的电离程度小于在纯水中的电离程度,故该说法错误,
故答案为:错误;
(3)一定温度下,醋酸的浓度越大,则电离程度越小,故该说法错误,
故答案为:错误;
(4)碳酸是分步电离的,第一电离常数表达式为:K1=$\frac{c({H}^{+})•c(HC{{O}_{3}}^{-})}{c({H}_{2}C{O}_{3})}$,第二步电离常数为:K2=$\frac{c({H}^{+})•c(C{{O}_{3}}^{2-})}{c(HC{{O}_{3}}^{-})}$,故该说法错误,
故答案为:错误;
(5)电离常数与温度有关,温度不变,则电离平衡常数不变,故该说法错误,
故答案为:错误.
点评 本题考查了弱电解质的电离平衡及其影响因素,题目难度中等,注意掌握影响弱电解质的电离平衡的因素,明确电离平衡常数只与温度有关,与溶液浓度大小无关.

练习册系列答案
 优学名师名题系列答案
优学名师名题系列答案
相关题目
20.下列化学用语表示正确的是( )
| A. | 钾原子结构示意图: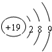 | B. | CCl4的电子式: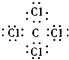 | ||
| C. | HClO的结构式:H-Cl-O | D. | MgCl2的电子式: |
1.下列有关卤族元素的叙述不正确的是( )
| A. | 卤族元素从F到I,其气态氢化物的稳定性逐渐减弱,HX水溶液酸性逐渐增强 | |
| B. | 卤族元素从Cl到I,最高价氧化物对应水化物的酸性减弱 | |
| C. | 卤族元素从F到I,HX的熔沸点:HF>HI>HBr>HCl | |
| D. | 卤素单质氧化性F2>Cl2>Br2>I2,因此排在前面的卤素单质均可将排在后面的卤素从它的盐溶液中置换出来 |
5.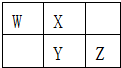 W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可使湿润的红色石蕊试纸变蓝,由此可知( )
W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可使湿润的红色石蕊试纸变蓝,由此可知( )
 W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可使湿润的红色石蕊试纸变蓝,由此可知( )
W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可使湿润的红色石蕊试纸变蓝,由此可知( )| A. | X、Y、Z中最简单氢化物稳定性最弱的是Y | |
| B. | Z元素氧化物对应水化物的酸性一定强于Y | |
| C. | W元素形成的单核阴离子半径小于X元素形成的单核阴离子半径 | |
| D. | Z元素单质在化学反应中只表现氧化性 |
15.铝与过量的稀盐酸反应,为了缓解反应速率,但是又不影响生产的氢气总量,下列采取措施能达到实验目的是( )
| A. | 加入一定体积的NaCl溶液 | B. | 加入一定体积的KNO3饱和溶液 | ||
| C. | 加入少量的Na2CO3固体 | D. | 加入少量的CuSO4固体 |
3.根据元素的单质和化合物的性质,判断元素非金属性强弱的依据一般是( )
| A. | 元素最高价氧化物对应的水化物的碱性的强弱 | |
| B. | 元素氧化物对应的水化物的酸性的强弱 | |
| C. | 元素的单质与氢气反应生成气态氢化物的难易 | |
| D. | 元素的单质与酸反应置换出氢的难易 |
4.甲苯最多有( )原子共平面.
| A. | 10 | B. | 11 | C. | 12 | D. | 13 |
 ;
;