题目内容
【题目】某课外兴趣小组为探究铜跟浓硫酸的反应情况,设计了图所示装置进行有关实验:
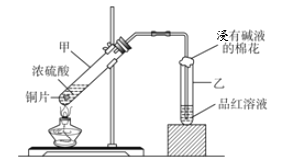
(1)通过试管乙中发生的_________现象说明了铜和浓硫酸发生了化学反应,并且该现象还能说明产生的气体具有_______性。
(2)写出试管甲所发生的化学反应方程式_________________________。
(3)试管乙口放置有碱液的棉花的作用是___________________________。
【答案】品红溶液褪色 漂白性 Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O 吸收有毒的尾气,防止污染大气
CuSO4+SO2↑+2H2O 吸收有毒的尾气,防止污染大气
【解析】
(1)品红褪色,说明二氧化硫有漂白性,说明铜和浓硫酸发生化学反应生成二氧化硫;
(2)浓硫酸具有强氧化性,在加热时可以氧化单质铜,生成硫酸铜、二氧化硫和水;
(3)依据二氧化硫是污染性气体,不能排放到大气中分析。
(1)品红褪色,说明二氧化硫有漂白性,说明铜和浓硫酸发生化学反应生成二氧化硫,因此答案为:品红溶液褪色;漂白;
(2)浓硫酸具有强氧化性,在加热时可以氧化单质铜,生成硫酸铜、二氧化硫和水,其反应方程式为:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;
(3)反应后的尾气中含有二氧化硫,二氧化硫有毒,直接排放都空气中会污染空气,氢氧化钠溶液的作用是:吸收反应产生的SO2,防止污染空气。

【题目】如表为几种短周期元素的性质,回答下列问题:
元素编号 | A | B | C | D | E | F | G | H |
原子半径/10-1nm | 0.74 | 1.54 | 1.30 | 1.18 | 1.11 | 1.06 | 0.99 | 0.75 |
最高或最低化合价 | -2 | +1 | +2 | +3 | +4,-4 | +5,-3 | +7,-1 | +5,-3 |
(1)E元素在元素周期表中的位置是_____;C元素与G元素形成化合物的电子式_____ 。
(2)D的单质与B的最高价氧化物对应水化物的溶液反应,其离子方程式为_________。
(3)B2A2中含有的化学键为_______,该物质与水反应的化学反应方程式为________。
(4)下列说法不正确的是______(填序号)。
①H的气态氢化物水溶液能导电,说明H的气态氢化物为电解质
②最高价氧化物对应水化物的碱性:B>C>D
③D的最高价氧化物对应水化物可以溶于氨水
④元素气态氢化物的稳定性:F>A>G