题目内容
【题目】含硫的物质与人们的生活密切相关。已知硫元素常见的化合价有-1、0、+4、+6四种,其不同价态的物质间可相互转化。完成下列填空:
(1)硫离子的结构示意图_____________。
(2)黑火药爆炸时,发生的反应之一为:S+2KNO3+3C![]() K2S+3CO2↑+N2↑该反应中1mol S能氧化C_______mol。
K2S+3CO2↑+N2↑该反应中1mol S能氧化C_______mol。
(3)将硫化氢气体与二氧化硫气体在集气瓶中混合发生反应,现象____________。二氧化硫呈现______________(选填“氧化性”、“还原性”)。
(4)二氧化硫是形成酸雨的“元凶”之一,由二氧化硫形成的酸雨的主要成分是硫酸。
以下是二氧化硫形成酸雨的两种途径:
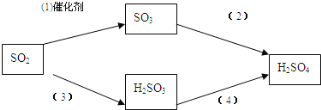
请分别写出(1)和(4)的化学方程式: ________________, ___________________。
(5)你认为减少酸雨产生的途径可采用的措施是_______________。
①少用煤作燃料 ②把工厂烟囱造高 ③燃料脱硫 ④在已酸化的土壤中加石灰 ⑤开发新能源
A. ①②③ B. ②③④ C. ①③⑤ D. ①③④⑤
(6)硫酸盐的种类很多,且应用广泛,医疗上常用_______(写化学式)作X射线透视肠胃的内服药剂,生活用水可以用_________(写化学式)作净水剂。
(7)有化学反应2SO2(g)+O2(g)![]() 2SO3(g) △H=-190kJ/mol,450℃往2L密闭容器中充入2mol SO2和1mol O2,5分钟后的SO2物质的量为0.5mol,则在5min内,用消耗的O2表示的反应速率为_____________________。在其它条件不变时,扩大容器体积,v(正)_______(选填“增大”或“减小”或“不变”),v(逆)______(选填“增大”或“减小”或“不变”)。
2SO3(g) △H=-190kJ/mol,450℃往2L密闭容器中充入2mol SO2和1mol O2,5分钟后的SO2物质的量为0.5mol,则在5min内,用消耗的O2表示的反应速率为_____________________。在其它条件不变时,扩大容器体积,v(正)_______(选填“增大”或“减小”或“不变”),v(逆)______(选填“增大”或“减小”或“不变”)。
【答案】![]() 0.5 瓶壁有淡黄色粉末和无色的小液滴 氧化性 2SO2+O2
0.5 瓶壁有淡黄色粉末和无色的小液滴 氧化性 2SO2+O2![]() 2SO3 2H2SO3+O2→2H2SO4 C BaSO4 KAl(SO4)212H2O 0.075mol/(Lmin) 减小 减小
2SO3 2H2SO3+O2→2H2SO4 C BaSO4 KAl(SO4)212H2O 0.075mol/(Lmin) 减小 减小
【解析】
(1)S原子获得2个电子变为S2-;
(2)根据S、C元素化合价变化数目等于电子转移数目计算;
(3)将硫化氢气体与二氧化硫气体混合,反应产生S单质和H2O,根据氧化还原反应规律,结合物质的状态、颜色,判断反应现象及物质的作用;
(4)SO2和氧气在催化剂的作用下产生SO3,H2SO3在溶液中被O2氧化产生硫酸;
(5)少用煤作燃料、燃料脱硫、开发新的能源等措施可以减少二氧化硫气体的排放,从而减少酸雨的形成,把工厂烟囱造高、在已酸化的土壤中加石灰等措施不能有效地防止酸雨的形成;
(6)硫酸钡不溶于水,不溶于酸,可作钡餐使用;明矾电离产生的铝离子遇水作用能够产生具有净水作用的物质;
(7)先根据速率定义计算v(SO2),然后根据速率比等于化学计量数的比计算v(O2),根据浓度对化学反应速率的影响分析判断速率变化。
(1)S是16号元素,S原子核外有16个电子,原子获得2个电子变为S2-,所以S2-的原子结构示意图为:![]() ;
;
(2)黑火药爆炸时,发生的反应之一为:S+2KNO3+3C![]() K2S+3CO2↑+N2↑,在该反应中S元素的化合价由单质S的0价变为反应后K2S 中的-2价,获得2个电子,C元素的化合价由反应前)价变为反应后CO2中是+4价,升高4价,由于元素化合价升降数目等于电子转移数目,在整个反应中电子转移数目相等,所以1mol S获得2mol电子,则其氧化C的物质的量是0.5mol;
K2S+3CO2↑+N2↑,在该反应中S元素的化合价由单质S的0价变为反应后K2S 中的-2价,获得2个电子,C元素的化合价由反应前)价变为反应后CO2中是+4价,升高4价,由于元素化合价升降数目等于电子转移数目,在整个反应中电子转移数目相等,所以1mol S获得2mol电子,则其氧化C的物质的量是0.5mol;
(3)将硫化氢气体与二氧化硫气体在集气瓶中混合发生反应:2H2S+SO2=3S+2H2O,反应后产生S单质是固体,呈淡黄色,同时还有小水滴生成,故反应后的现象为:瓶壁有淡黄色粉末和无色的小液滴;在该反应中,SO2中S化合价为+4价,反应后变为0价的单质S,化合价降低,获得电子,被还原,所以SO2为氧化剂,表现氧化性;
(4)反应(1)是SO2与O2在催化剂存在和加热时发生反应产生SO3,该反应的化学方程式为:2SO2+O2![]() 2SO3;
2SO3;
反应(4)是H2SO3在溶液中被O2氧化产生H2SO4,根据原子守恒、电子守恒,可得反应的化学方程式为:2H2SO3+O2→2H2SO4;
(5)②把工厂烟囱造高、④在已酸化的土壤中加石灰等措施不能从源头有效地防止酸雨的形成,①少用煤作燃料、③燃料脱硫、⑤开发新的能源等措施可以减少二氧化硫气体的排放,从而减少酸雨的形成,故减少酸雨产生的途径可采用的措施是①③⑤,合理选项是C;
(6)硫酸钡不溶于水,不溶于酸,可作钡餐使用,硫酸钡作X射线透视肠胃的内服药剂,化学式为BaSO4;
明矾溶于水,电离产生的铝离子与水作用能够产生的氢氧化铝表面积大,吸附力强,可以吸附水中悬浮的固体物质,因而具有净水作用,所以净水剂是KAl(SO4)212H2O;
(7)根据速率定义可得v(SO2)=![]() =0.15 mol/(Lmin),由于用不同物质表示反应速率时,速率比等于化学计量数的比,所以v(O2)=
=0.15 mol/(Lmin),由于用不同物质表示反应速率时,速率比等于化学计量数的比,所以v(O2)= ![]() v(SO2)=0.075 mol/(Lmin),在其它条件不变时,扩大容器体积,气体物质的浓度降低,则v(正)减小,v(逆)也减小。
v(SO2)=0.075 mol/(Lmin),在其它条件不变时,扩大容器体积,气体物质的浓度降低,则v(正)减小,v(逆)也减小。

 口算题卡北京妇女儿童出版社系列答案
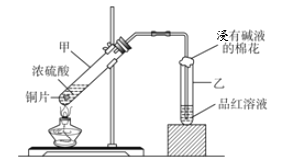
口算题卡北京妇女儿童出版社系列答案【题目】利用如图所示装置进行下列实验,能得出相应实验结论是( )
选项 | ① | ② | ③ | 实验结论 |
|
A | 稀硫酸 | Na2S | CuSO4溶液 | H2S酸性强于H2SO4 | |
B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
C | 稀盐酸 | 亚硫酸钠 | 硝酸钡溶液 | 二氧化硫与可溶性钡盐均可生成白色沉淀 | |
D | 浓硝酸 | 碳酸钠 | 硅酸钠溶液 | 酸性:硝酸>碳酸>硅酸 |
A. A B. B C. C D. D