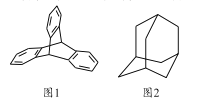
题目内容
【题目】如表为几种短周期元素的性质,回答下列问题:
元素编号 | A | B | C | D | E | F | G | H |
原子半径/10-1nm | 0.74 | 1.54 | 1.30 | 1.18 | 1.11 | 1.06 | 0.99 | 0.75 |
最高或最低化合价 | -2 | +1 | +2 | +3 | +4,-4 | +5,-3 | +7,-1 | +5,-3 |
(1)E元素在元素周期表中的位置是_____;C元素与G元素形成化合物的电子式_____ 。
(2)D的单质与B的最高价氧化物对应水化物的溶液反应,其离子方程式为_________。
(3)B2A2中含有的化学键为_______,该物质与水反应的化学反应方程式为________。
(4)下列说法不正确的是______(填序号)。
①H的气态氢化物水溶液能导电,说明H的气态氢化物为电解质
②最高价氧化物对应水化物的碱性:B>C>D
③D的最高价氧化物对应水化物可以溶于氨水
④元素气态氢化物的稳定性:F>A>G
【答案】 第3周期ⅣA 族 ![]() 2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑ 离子键 共价键 2Na2O2+2H2O=4NaOH+O2↑ ①③④
2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑ 离子键 共价键 2Na2O2+2H2O=4NaOH+O2↑ ①③④
【解析】根据图表数据及元素周期律的相关知识,同周期原子半径从左到右逐渐减小,同主族原子半径从上到小逐渐增大。短周期元素的最高正价等于其最外层电子数(氧元素和氟元素无最高正价)。根据图表数据可知,F、H的最高正价均为+5,则两者位于第ⅤA族,F的原子半径大于H的原子半径,因此F为磷元素,H为氮元素。A的原子半径小于H,并且没有最高正价,只有最低负价-2价可知A为氧元素;原子半径B>C>D>E>F>G,并且最高正价依次增大,可知B为钠元素,C为镁元素,D为铝元素,E为硅元素,G为氯元素。
(1)根据上述分析可知E元素为硅元素,位于元素周期表第3周期ⅣA 族;C为镁元素,G为氯元素两者形成的化合物为氯化镁,为离子化合物,其电子式为:![]() ;(2)D为铝元素,B为钠元素,B的最高价氧化物对应水化物的溶液为氢氧化钠溶液,铝单质既可以和酸反应生成氢气,又可以和强碱溶液反应生成氢气,反应方程式为:2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑;(3)B2A2是过氧化钠,其为离子化合物,即存在钠离子与过氧根间的离子键,也存在氧原子与氧原子间的共价键。过氧化钠与水反应的方程式为:2Na2O2+2H2O=4NaOH+O2↑;(4)①H的气态氢化物为氨气,水溶液能导电是因为氨气与水反应生成一水合氨,一水合氨电离出自由移动的离子使溶液导电,因此氨气不是电解质,而是非电解质,错误;②B、C、D分别为钠元素,镁元素,铝元素,根据元素周期律可知金属性越强,其最高价氧化物对应水化物的碱性越强,因此碱性氢氧化钠>氢氧化镁>氢氧化铝,正确;③D的最高价氧化物对应水化物为氢氧化铝,可溶于强碱,但不能溶于弱碱,因此氢氧化铝不能溶于氨水,错误;④由元素周期律可知,元素的非金属性越强,元素气态氢化物越稳定,F为磷元素,G为氯元素,氯元素非金属性强,则HCl稳定性强于PH3,错误;故选①③④。
;(2)D为铝元素,B为钠元素,B的最高价氧化物对应水化物的溶液为氢氧化钠溶液,铝单质既可以和酸反应生成氢气,又可以和强碱溶液反应生成氢气,反应方程式为:2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑;(3)B2A2是过氧化钠,其为离子化合物,即存在钠离子与过氧根间的离子键,也存在氧原子与氧原子间的共价键。过氧化钠与水反应的方程式为:2Na2O2+2H2O=4NaOH+O2↑;(4)①H的气态氢化物为氨气,水溶液能导电是因为氨气与水反应生成一水合氨,一水合氨电离出自由移动的离子使溶液导电,因此氨气不是电解质,而是非电解质,错误;②B、C、D分别为钠元素,镁元素,铝元素,根据元素周期律可知金属性越强,其最高价氧化物对应水化物的碱性越强,因此碱性氢氧化钠>氢氧化镁>氢氧化铝,正确;③D的最高价氧化物对应水化物为氢氧化铝,可溶于强碱,但不能溶于弱碱,因此氢氧化铝不能溶于氨水,错误;④由元素周期律可知,元素的非金属性越强,元素气态氢化物越稳定,F为磷元素,G为氯元素,氯元素非金属性强,则HCl稳定性强于PH3,错误;故选①③④。

 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案【题目】锰的用途非常广泛,以碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴的碳酸盐及SiO2杂质)为原料生产金属锰的工艺流程如下:

已知25℃,部分物质的溶度积常数如下:
物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | Fe(OH)3 | MnS | CoS | NiS |
Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.1×10-36 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
(1)步骤Ⅰ中,为加快溶浸速率,可采取的措施是____________________(至少答两条)
(2)步骤Ⅱ中,加氨水调节溶液的pH为5.0~6.0,则滤渣1的成分主要为______(填化学式);已知MnO2的作用为氧化剂,“除杂1”中涉及的离子方程式为:NH3﹒H2O+H+==NH4+ +H2O、__________________、___________________。
(3)步骤Ⅲ中,所加(NH4)2S的浓度不宜过大的原因是_______________________。
(4)滤液2中,c(Co2+) :c(Ni2+)=_______________。
(5)将质量为a㎏的碳酸锰矿经上述流程处理后得到单质Mn b kg。若每一步都进行完全,假设滤渣1为含铁元素的纯净物,质量为c kg,则原碳酸锰矿中MnCO3的质量分数为_________(用含a、b、c的式子表达,无需化简)。