题目内容
2.A、B、C、D、E是中学化学常见的五种元素,原子序数依次增大,其结构或性质信息如下表:| 元素 | 结构或性质信息 |
| A | 其原子最外层电子数是内层电子数的2倍 |
| B | 基态原子最外层电子排布为nSnnPn+1 |
| C | 非金属元素,其单质为固体,在氧气中燃烧时有明亮的蓝紫色火焰 |
| D | 单质在常温、常压下是气体.基态原子的M层上有1个未成对的P电子 |
| E | 其与A形成的合金为目的用量最多的金属材料 |
(2)比较B与O元素的第一电离能:B>O,A与C的电负性:A<C (填<,=或>);A D形成的一种常见化合物,常温下为液体,是良好的有机溶剂,其分子中含有的共价键类型是σ键.(填“σ键”或“π键”).
(3)写出工业上制备D单质的离子方程式2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+2OH-+H2↑;
(4)E单质在海水中易发生电化学腐蚀,写出正极的电极反应式O2+2H2O+4e-=4OH-;
(5)在一定条件下,B与D可形成一种化合物,该化合物分子中每个原子最外层均为8电子,常温下为淡黄色液体,遇水强烈水解,生成两种产物,其中之一的分子构型为三角锥形,另一种产物具有漂白性,写出该化合物与水反应的化学方程式:NCl3+3H2O═NH3+3HClO.
(6)己知单质B生成4.25g气态氢化物W时,释放出11.55KJ的热量.写出该反应的热化学方程式N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ/mol.
分析 A原子最外层电子数是内层电子数的2倍,最外层最多含有8个电子,则A原子只能有两个电子层,最外层含有4个C,则A为碳元素;B的基态原子最外层电子排布为nsnnpn+1,s能级最多容纳2个电子,且P能级容纳电子,则n=2,B原子的最外层电子排布式为:2s22p3,则B为N元素;C为非金属元素,其单质为固体,在氧气中燃烧时有明亮的蓝紫色火焰,则C为S元素;D的基态原子的M层上有1个未成对的p电子,则其电子排布式为1s22s22p63s23p1或1s22s22p63s23p5,为铝元素或氯元素,由于D单质常温、常压下是气体,所以D是Cl元素;E与A形成的合金为目前用量最多的金属材料,该合金为钢,则E为Fe元素,据此解答.
解答 解:A原子最外层电子数是内层电子数的2倍,最外层最多含有8个电子,则A原子只能有两个电子层,最外层含有4个C,则A为碳元素;B的基态原子最外层电子排布为nsnnpn+1,s能级最多容纳2个电子,且P能级容纳电子,则n=2,B原子的最外层电子排布式为:2s22p3,则B为N元素;C为非金属元素,其单质为固体,在氧气中燃烧时有明亮的蓝紫色火焰,则C为S元素;D的基态原子的M层上有1个未成对的p电子,则其电子排布式为1s22s22p63s23p1或1s22s22p63s23p5,为铝元素或氯元素,由于D单质常温、常压下是气体,所以D是Cl元素;E与A形成的合金为目前用量最多的金属材料,该合金为钢,则E为Fe元素.
(1)E为Fe元素,铁原子核外有26个电子,基态原子的电子排布式为:1s22s22p63s23p63d64s2,
故答案为:1s22s22p63s23p63d64s2;
(2)N原子的2p能级容纳3个电子,是半充满稳定状态,能量较低,因此第一电离能N>O;硫元素的非金属性强于碳,故电负性C<S,A和D形成的化合物为CCl4,含有化学键为σ键,
故答案为:>;<;σ键;
(3)D为氯元素,其单质为氯气,工业上电解氯化钠溶液制备氯气,反应的离子方程式为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+2OH-+H2↑,
故答案为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+2OH-+H2↑;
(4)fe单质在海水中易发生电化学腐蚀,发生吸氧腐蚀,正极上是氧气获得电子生成氢氧根离子,正极的电极反应式为:O2+2H2O+4e-=4OH-,
故答案为:O2+2H2O+4e-=4OH-;
(5)在一定条件下,N与Cl可形成一种化合物,该化合物分子中每个原子最外层均为8电子,该化合物为NCl3,遇水强烈水解,生成两种产物,其中之一的分子构型为三角锥形,另一种产物具有漂白性,水得到氨气与HClO,该化合物与水反应的化学方程式:NCl3+3H2O═NH3+3HClO,
故答案为:NCl3+3H2O═NH3+3HClO;
(6)氮气生成4.25g气态氢化物NH3时,释放出11.55KJ的热量,生成2mol氨气放出的热量为11.55kJ×$\frac{2mol×17g/mol}{4.25g}$=92.4kJ,该反应的热化学方程式为:N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ/mol,
故答案为:N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ/mol.
点评 本题考查位置结构与性质关系的应用,正确推断各元素是解题关键,需要学生具备扎实的基础,有利于学生巩固基础知识和基本技能,题目难度中等.

 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案| A. | CO和 N2为等电子体,22.4L的CO气体和1mol N2所含的电子数相等 | |
| B. | 1L密度为1.84g•cm-3质量分数为98%的硫酸溶液中,所含氢原子数为36.8NA | |
| C. | 在标准状况下,32g氧气和臭氧的混合气体中含氧原子数为2NA | |
| D. | 在标准状况下,30g福尔马林和22.4L三氧化硫所含氧原子数之比为1:3 |
| A. | (3m+n)mol | B. | ($\frac{5}{2}m+\frac{n}{2}•3p$)mol | C. | (3m+n+2p)mol | D. | ($\frac{5}{2}m+\frac{n}{2}$)mol |
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 向1mL 2mol•L-1 NaOH溶液加入2滴0.1mol•L-1 MgCl2溶液,再滴加2滴0.1mol•L-1 FeCl3溶液 | 先生成白色沉淀, 后生成红褐色沉淀 | Fe(OH)3比Mg(OH)2 更难溶 |
| B | 向NH3•H2O溶液中滴加少量AgNO3溶液 | 无明显现象 | NH3•H2O和AgNO3 不反应 |
| C | 向试管中某溶液加入NaOH溶液 | 试管口湿润的红色石蕊试纸不变蓝 | 溶液中无NH4+ |
| D | 浓硫酸加入Cu片后,加热 | 有白色固体生成 | 白色固体为CuSO4 |
| A. | A | B. | B | C. | C | D. | D |
| A. | ⅠA族元素都是碱金属元素 | |
| B. | 碱金属单质可将铜从其盐溶液中置换出来 | |
| C. | 金属钾具有强还原性,K+具有强氧化性 | |
| D. | Cs常温下与水反应会发生爆炸 |
| A. | 牛油、纤维素和蛋白质都是天然高分子化合物 | |
| B. | 淀粉可以使碘化钾试纸变蓝 | |
| C. | 葡萄糖能发生氧化反应和水解反应 | |
| D. | 浓硝酸溅在皮肤上,使皮肤呈黄色是由于浓硝酸和蛋白质发生了颜色反应 |
| A. | 11种 | B. | 12种 | C. | 13种 | D. | 14种 |
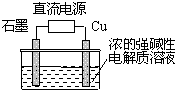 Cu2O是一种半导体材料,制取Cu2O的电解池如图,总反应为:2Cu+H2O$\frac{\underline{\;通电\;}}{\;}$Cu2O+H2↑.下列说法不正确的是( )
Cu2O是一种半导体材料,制取Cu2O的电解池如图,总反应为:2Cu+H2O$\frac{\underline{\;通电\;}}{\;}$Cu2O+H2↑.下列说法不正确的是( )| A. | 铜电极发生氧化反应 | |
| B. | 铜电极接直流电源的负极 | |
| C. | 石墨电极上产生氢气 | |
| D. | 每生成1molCu2O时,就有2mol电子转移 |