题目内容
【题目】NO用途广泛,对其进行研究具有重要的价值和意义
(1)2NO(g)+O2(g)=2NO2(g)△H=akJmol-1的反应历程与能量变化关系如图所示。已知:第Ⅱ步反应为:NO3(g)+NO(g)=2NO2(g)△H=bkJmol-1
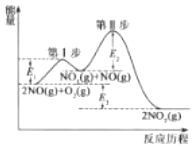
①第I步反应的热化学方程式为__。
②关于2NO(g)+O2(g)=2NO2(g)的反应历程,下列说法正确的是__。
A.相同条件下,决定该反应快慢的步骤为第Ⅱ步反应
B.使用合适的催化剂会使E1、E2、E3同时减小
C.第I步反应为吸热反应,第Ⅱ步反应为放热反应
D.反应的中同产物是NO3和NO
(2)NO的氢化还原反应为2NO(g)+2H2(g)N2(g)+2H2O(g)。研究表明:某温度时,v正=kcm(NO)cn(H2),其中k=2.5×103mol(m+n-1)L(m+n-1)s-1.该温度下,当c(H2)=4.0×10-3molL-1时,实验测得v正与c(NO)的关系如图一所示,则m=___,n=___。
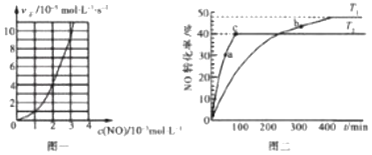
(3)NO易发生二聚反应2NO(g)N2O2(g)。在相同的刚性反应器中充入等量的NO,分别发生该反应。不同温度下,NO的转化率随时间(t)的变化关系如图二所示。
①该反应的△H___0(填“>”“<”或“=”)。
②T1温度下,欲提高NO的平衡转化率,可采取的措施为__(任写一条即可)。
③a、b处正反应速率va__vb(填”>”“<”或“=”),原因为___。
④e点对应体系的总压强为200kPa,则T2温度下,该反应的平衡常数kp=___kPa-1(Kp为以分压表示的平衡常数)
【答案】O2(g)+NO(g)=NO3(g) △H=(a-b)kJmol-1 AC 2 1 < 增大NO浓度(或降温、压缩气体、及时分离N2O2等) > 对应温度a点高于b点,NO的浓度a点大于b点 ![]()
【解析】
(1)①总反应为:2NO(g)+O2(g)=2NO2(g)△H=akJmol-1,第Ⅱ步反应:NO3(g)+NO(g)=2NO2(g)△H=bkJmol-1
根据盖斯定律:第Ⅰ步反应=总反应-第Ⅱ步反应得到第Ⅰ步反应的热化学方程式;
②A、总反应的反应速率一般由历程中反应速率小的反应决定;
B、根据催化剂只改变反应速率,不能改变反应进程;
C、反应热△H=生成物的总能量-反应物的总能量,若生成物的总能量>反应物的总能量,则反应吸热,反之相反;
D、NO3为第Ⅰ步反应的生成物、为第II步反应的反应物。
(2)将(1×10-3,1×10-5)和(2×10-3,4×10-5)代入v正=2.5×103cm(NO)cn(4.0×10-3)计算m、n值;
(3)①根据图象可知,温度T2>T1,分析T2℃时NO的转化率小于T1℃时NO的转化率即可解答;
②能使该反应的平衡正向移动的措施均能提高NO的平衡转化率,结合反应正向移动的条件分析解答。
③a点NO的转化率小于b点,即体系中a点的c(NO)大与b点,并且a点温度大于b点,结合温度和浓度对化学反应速率影响解答;
④根据反应的三段式计算平衡时n(NO)、n(N2O2)和平衡分压p(NO)、p(N2O2),代入分压平衡常数Kp=![]() 中计算Kp。
中计算Kp。
(1)①总反应为:2NO(g)+O2(g)=2NO2(g)△H=akJmol-1,第Ⅱ步反应:NO3(g)+NO(g)=2NO2(g)△H=bkJmol-1,由盖斯定律有:第Ⅰ步反应=总反应-第Ⅱ步反应得到第Ⅰ步反应的热化学方程式O2(g)+NO(g)=NO3(g)△H=(a-b)kJmol-1;
②A、由图可知,第Ⅱ步反应的活化能高,导致第Ⅱ步反应速率慢,总反应的反应速率一般由历程中反应速率小的反应决定,所以决定该反应快慢的步骤为第Ⅱ步反应,故A正确;
B、催化剂会降低E1、E2,不能改变反应热E3,故B错误;
C、反应热△H=生成物的总能量-反应物的总能量,第I步反应中生成物的总能量<反应物的总能量,第II步反应中生成物的总能量>反应物的总能量,所以第I步反应为吸热反应,第Ⅱ步反应为放热反应,故C正确;
D、NO3为第Ⅰ步反应的生成物、为第II步反应的反应物,所以NO3为中间产物,但NO为反应的反应物,故D错误;
故答案为:AC;
(2)将(1×10-3,1×10-5)和(2×10-3,4×10-5)代入v正=2.5×103cm(NO)cn(4.0×10-3)有2.5×103×(1×10-3)m(4.0×10-3)n=1×10-5,2.5×103×(2×10-3)m(4.0×10-3)n=4×10-5,解得m=2,n=1;
(3)①根据“先拐先平,数值大”可知,温度T2>T1,并且T2℃时NO的转化率小于T1℃时NO的转化率,即升高温度NO的转化率降低,则升高温度平衡逆向进行,所以逆向吸热、正反应放热,△H<0;
②NO的二聚反应2NO(g)N2O2(g)正向是体积减小的放热反应,能使该反应的平衡正向移动的措施均能提高NO的平衡转化率,如加压、降温、增大NO浓度等,即:增大NO浓度(或降温、压缩气体、及时分离N2O2等);
③
④设起始时n(NO)=2mol,则反应三段式为
2NO(g)N2O2(g)
起始量(mol)2 0
变化量(mol)0.8 0.4
平衡量(mol)1.2 0.4
p(NO)=![]() ×200Mpa=150Mpa、p(N2O2)=50Mpa,所以c点时反应的平衡常数kp=
×200Mpa=150Mpa、p(N2O2)=50Mpa,所以c点时反应的平衡常数kp=![]() =
=![]() =
=![]() kPa-1。
kPa-1。

【题目】《汉书景帝纪》记载,我国用锌的历史可追溯到西汉或更早。请回答:
(1)基态Zn原子的价层电子轨道表达式为___;占据最高能层的电子,其电子云轮廓图形状为____。
(2)与相邻元素Ga相比,元素Zn的第一电离能较大的原因为___。
(3)Zn2+可与CN-、二苯硫腙 等形成稳定配合物。
等形成稳定配合物。
①CN-的结构式为___。
②每个二苯硫腙分子中,采取sp2杂化的原子有___个。
(4)卤化锌的熔点如表所示:
ZnF2 | ZnCl2 | ZnBr2 | ZnI2 | |
熔点/℃ | 872 | 275 | 394 | 446 |
①ZnCl2、ZnBr2、ZnI2的熔点呈表中变化规律的原因____。
②ZnF2的熔点远高于其它三种卤化锌,其原因为___。
(5)ZnS的某种晶胞结构如图所示。已知该晶体的密度为dg.cm-3,S2-和Zn2+半径分别为apm、bpm,阿伏伽德罗常数的数值为NA。
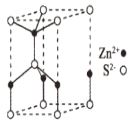
①Zn2+的配位数为___。
②该晶胞中离子的体积占晶胞体积的百分率为__(列式即可)