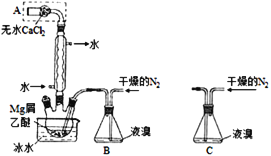
题目内容
【题目】为探究某盐X(仅含四种元素,其摩尔质量小于300g/mol)设计并完成如下实验:
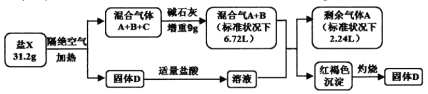
已知:气体A为单质,标准状况下的密度为1.25g/L。请回答:
(1)盐X的组成元素为H、O和____________(用元素符号表示)。
(2)写出固体D和过量HI溶液反应的离子方程式__________。
(3)写出盐X隔绝空气加热分解的化学方程式__________。
【答案】N、Fe Fe2O3+6H++2I—=2Fe2++I2+3H2O 2(NH4)2FeO4![]() Fe2O3+2NH3↑+N2↑+5H2O
Fe2O3+2NH3↑+N2↑+5H2O
【解析】
通过各物质的所含元素的物质的量的比例,可以知道该物质的分子式。
混合气体A+B+C通过碱石灰,碱石灰增重9g,H2O或者CO2,或者两者的混合物的质量为9g。混合气体通过溶液后,生成了红褐色沉淀。红褐色沉淀为Fe(OH)3,则混合气体中含有NH3。气体A为单质,标准状况下的密度为1.25 g·L-1,则其摩尔质量为22.4L·mol-1×1.25g·L-1=28g·mol-1,则气体A为氮气,其物质的量为0.1mol,质量为2.8g。B气体为NH3,其物质的量![]() ,质量为3.4g。则盐含有的元素为N、H、Fe。如果气体C为CO2,所含元素种类超过了4种,则气体C为H2O,另一种元素为O。H2O的质量为9g,物质的量为0.5mol。盐X的质量为31.2g, 气体A+B+C的总质量为2.8g+3.4g+9g=15.2g。则分解生成D的质量为31.2g-15.2g=16g,则Fe2O3的物质的量
,质量为3.4g。则盐含有的元素为N、H、Fe。如果气体C为CO2,所含元素种类超过了4种,则气体C为H2O,另一种元素为O。H2O的质量为9g,物质的量为0.5mol。盐X的质量为31.2g, 气体A+B+C的总质量为2.8g+3.4g+9g=15.2g。则分解生成D的质量为31.2g-15.2g=16g,则Fe2O3的物质的量![]() 。该分解反应生成的H2O、NH3、N2、Fe2O3的物质的量分别为0.5mol、0.2mol、0.1mol、0.1mol,则H、N、O、Fe的物质的量为1.6mol、0.4mol、0.8mol、0.2mol,比例为8:2:4:1。该反应为铵盐分解,则分子式为H8N2O4Fe,化学是为(NH4)2FeO4。
。该分解反应生成的H2O、NH3、N2、Fe2O3的物质的量分别为0.5mol、0.2mol、0.1mol、0.1mol,则H、N、O、Fe的物质的量为1.6mol、0.4mol、0.8mol、0.2mol,比例为8:2:4:1。该反应为铵盐分解,则分子式为H8N2O4Fe,化学是为(NH4)2FeO4。
(1)根据上述的分析,盐X所含元素有H、O外,还有N和Fe;
(2)Fe2O3是碱性氧化物,HI为强酸,生成盐和水,但是生成Fe3+能够将I-氧化成I2,Fe3+还原成Fe2+,为氧化还原反应,则化学方程式为Fe2O3+6H++2I—=2Fe2++I2+3H2O;
(3)根据上述分析盐X为(NH4)2FeO4,其分解产物包括了H2O、Fe2O3、N2、NH3,该反应为氧化还原反应,Fe的化合价从+6降低到+3,还原产物Fe2O3中2个Fe,化合价总共降低6价,NH4+中的部分N的化合价从-3升高到0,N2中有2个N原子,化合价总共升高6价,化合价升降守恒,则还原产物Fe2O3和氧化产物N2的比例为1:1,则根据原子守恒和化合价守恒,化学方程式为2(NH4)2FeO4![]() Fe2O3+2NH3↑+N2↑+5H2O。
Fe2O3+2NH3↑+N2↑+5H2O。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】《汉书景帝纪》记载,我国用锌的历史可追溯到西汉或更早。请回答:
(1)基态Zn原子的价层电子轨道表达式为___;占据最高能层的电子,其电子云轮廓图形状为____。
(2)与相邻元素Ga相比,元素Zn的第一电离能较大的原因为___。
(3)Zn2+可与CN-、二苯硫腙 等形成稳定配合物。
等形成稳定配合物。
①CN-的结构式为___。
②每个二苯硫腙分子中,采取sp2杂化的原子有___个。
(4)卤化锌的熔点如表所示:
ZnF2 | ZnCl2 | ZnBr2 | ZnI2 | |
熔点/℃ | 872 | 275 | 394 | 446 |
①ZnCl2、ZnBr2、ZnI2的熔点呈表中变化规律的原因____。
②ZnF2的熔点远高于其它三种卤化锌,其原因为___。
(5)ZnS的某种晶胞结构如图所示。已知该晶体的密度为dg.cm-3,S2-和Zn2+半径分别为apm、bpm,阿伏伽德罗常数的数值为NA。
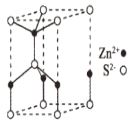
①Zn2+的配位数为___。
②该晶胞中离子的体积占晶胞体积的百分率为__(列式即可)