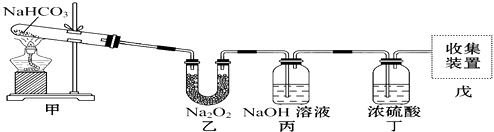
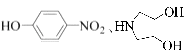题目内容
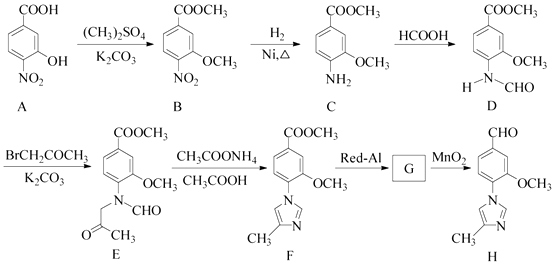
【题目】把0.6molW气体和0.5molX气体混合于2L密闭容器中,使它们发生如下反应:4W(g)+3X(g) ![]() 2Y(g)+nZ(g)。2min末已生成0.2mol Y,若测知以Z的浓度变化表示的反应速率为0.0025mol/(L·s),试计算
2Y(g)+nZ(g)。2min末已生成0.2mol Y,若测知以Z的浓度变化表示的反应速率为0.0025mol/(L·s),试计算
(1)前2min内用W的浓度变化表示的平均反应速率为_______________。
(2)2min末时X的浓度为_____________________________。
(3)化学反应方程式中n=_____________________________。
(4)2min末,恢复到反应前温度,体系内压强是反应前压强的__________倍。
【答案】 0.1mol/(L·min) 0.1mol/L n=6 12/11
【解析】试题分析:本题考查化学反应速率的计算。
(1)前2min内用Y浓度变化表示的平均反应速率为υ(Y)=![]() =0.05mol/(L·min),根据不同物质表示的速率之比等于化学计量数之比,υ(W):υ(Y)=4:2,υ(W)=2υ(Y)=2
=0.05mol/(L·min),根据不同物质表示的速率之比等于化学计量数之比,υ(W):υ(Y)=4:2,υ(W)=2υ(Y)=2![]() 0.05mol/(L·min)=0.1mol/(L·min)。
0.05mol/(L·min)=0.1mol/(L·min)。
(2)根据反应方程式,前2min内生成0.2molY消耗0.3molX,2min末X物质的量为0.5mol-0.3mol=0.2mol,2min末X的浓度为0.2mol![]() 2L= 0.1mol/L。
2L= 0.1mol/L。
(3)υ(Z)=0.0025mol/(L·s),将单位换算υ(Z)=0.15mol/(L·min),υ(Y):υ(Z)=0.05mol/(L·min):0.15mol/(L·min)=2:n,n=6。
(4)用三段式, 4W(g)+3X(g)![]() 2Y(g)+6Z(g)
2Y(g)+6Z(g)
n(起始)(mol) 0.6 0.5 0 0
n(转化)(mol) 0.4 0.3 0.2 0.6
n(2min末)(mol)0.2 0.2 0.2 0.6
2min末气体总物质的量为0.2mol+0.2mol+0.2mol+0.6mol=1.2mol,开始气体总物质的量为0.6mol+0.5mol=1.1mol,2min末恢复到反应前温度,温度和体积相同时气体压强之比等于气体物质的量之比,2min末体系内压强是反应前压强的![]() =
=![]() 倍。
倍。

【题目】已知:2KMnO4+16HCl═2KCl+5Cl2↑+2MnCl2+8H2O,如图所示是验证氯气性质的微型实验,a、b、c、d、e是浸有相关溶液的滤纸.向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面.对实验现象的“解释或结论”正确的是( )

选项 | 实验现象 | 解释或结论 |
A | a处变蓝,b处变红棕色 | 氧化性:Cl2>I2 Cl2>Br2 |
B | c处先变红,后褪色 | 氯气与水生成了酸性物质 |
C | d处立即褪色 | 氯气与水生成了漂白性物质 |
D | e处变红色 | 还原性:Cl->Fe2+ |
A. A B. B C. C D. D