题目内容
【题目】元素周期表中短周期主族元素W、X、Y、Z,原予序数依次增大,W的液态单质应用于航天领域,是火箭起飞的重要燃料;X元素原子的最外层电子数是内层电子数的3倍;元素Y在自然界中只能以化合态存在,而且元素Y在组成海水盐类物质的所有元素中,质量分数为第二;Z元素原子在同周期中原子半径最小。下列说法错误的是( )
A.Z的单质与W、Y的单质都能反应,且反应中Z的单质都作氧化剂
B.X的单质与Y的单质在常温条件下反应生成化合物甲,用电子式表示甲的形成过程为:![]()
C.Y与W可以形成原子个数比为1:1的化合物乙,且乙与水反应有气体产生
D.W与X形成的含有极性共价键的化合物不只有一种
【答案】B
【解析】
W原子序数最小且液态单质是火箭起飞的重要燃料,W为氢元素;X元素原子的最外层电子数是内层电子数的3倍,则X为氧元素;元素Y在组成海水盐类物质(NaCl、MgCl2、CaCl2等)的所有元素中,质量分数为第一的是氯元素,第二的是钠元素,则Y为钠元素;Z的原子序数最大且在同周期中原子半径最小,则Z为氯元素。
A.Z的单质与W、Y的单质都能反应,氯气与氢气、钠反应中,将氢气、钠分别氧化为氯化氢和氯化钠,表现强氧化性,A正确;
B.X的单质与Y的单质反应时,钠与氧气常温下反应生成氧化钠,氧化钠的形成过程为![]() ,B错误;
,B错误;
C.Y与W可以形成原子个数比为1:1的化合物NaH,NaH与水反应发生反应生成氢气,C正确;
D.W 与X形成的含有共价键的化合物有H2O、H2O2,二者均含有极性共价键,D正确;
故选B。

 名校课堂系列答案
名校课堂系列答案【题目】《汉书景帝纪》记载,我国用锌的历史可追溯到西汉或更早。请回答:
(1)基态Zn原子的价层电子轨道表达式为___;占据最高能层的电子,其电子云轮廓图形状为____。
(2)与相邻元素Ga相比,元素Zn的第一电离能较大的原因为___。
(3)Zn2+可与CN-、二苯硫腙 等形成稳定配合物。
等形成稳定配合物。
①CN-的结构式为___。
②每个二苯硫腙分子中,采取sp2杂化的原子有___个。
(4)卤化锌的熔点如表所示:
ZnF2 | ZnCl2 | ZnBr2 | ZnI2 | |
熔点/℃ | 872 | 275 | 394 | 446 |
①ZnCl2、ZnBr2、ZnI2的熔点呈表中变化规律的原因____。
②ZnF2的熔点远高于其它三种卤化锌,其原因为___。
(5)ZnS的某种晶胞结构如图所示。已知该晶体的密度为dg.cm-3,S2-和Zn2+半径分别为apm、bpm,阿伏伽德罗常数的数值为NA。
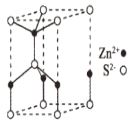
①Zn2+的配位数为___。
②该晶胞中离子的体积占晶胞体积的百分率为__(列式即可)