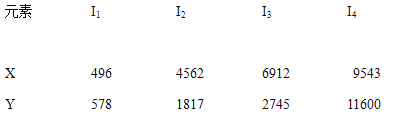题目内容
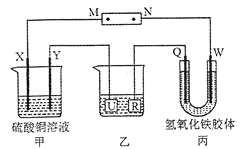
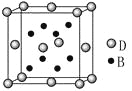
【题目】已知A、B、C、D、E是元素周期表中1~36号元素,其原子序数依次增大,且A、B、C、D为主族元素。A与另外四种元素既不在同一周期,也不在同一主族。B和C同主族,D和E同周期;元素E是周期表中的第7列元素,D的最外层电子数与最内层电子数相同,D跟B可形成离子化合物,其晶胞结构(其中B原子在晶胞内部)如图。
请回答下列问题:
(1)C-的电子排布式为_______;E元素原子的价电子排布式为________。
(2)元素B与氮元素可以形成化合物NB3,其中N-B键的化学键类型为________,根据价层电子对互斥理论可以判断NB3的空间构型为________,NB3分子中N原子的杂化方式为________杂化。
(3)A、B形成的化合物AB的相对分子质量比A、C形成的化合物AC的相对分子质量小,但AB的沸点比AC高,其原因是_________________________。
(4)从晶胞图可以得出:D与B形成的离子化合物的化学式为______________。
(5)含有D元素的化合物焰色反应为______色,焰色反应的原理是__________。
【答案】1s22s22p63s23p6 3d54s2 共价键(或极性共价键) 三角锥形 sp3 前者分子间存在氢键 CaF2 砖红 激发态电子从能量较高的轨道跃迁到能量较低的轨道,以光的形式释放出能量
【解析】
A、B、C、D、E是元素周期表中1~36号元素,其原子序数依次增大,元素E是周期表中的第7列元素,所以E是Mn元素;D的最外层电子数与最内层电子数相同,且与E同周期,所以D是第四周期第ⅡA元素Ca元素;D跟B可形成离子化合物,根据晶胞结构判断,该晶胞中有4个D、8个B,所以该离子化合物的化学式为DB2,则B为第ⅦA元素,B和C同主族,因此B、C分别是F、Cl元素;A与另外四种元素既不在同一周期,也不在同一主族,所以A是H元素。据此解答。
(1)Cl-的核外有18个电子,电子排布式为1s22s22p63s23p6;Mn是第ⅦB族元素,价电子排布式为3d54s2;
(2)NF3分子中中心原子的价层电子对数=3+(5-3×1)/2=4,有1对孤对电子,所以空间构型为三角锥形;利用杂化轨道理论判断N原子的杂化方式为sp3杂化。
(3)HF的沸点比HCl的沸点高的原因是HF分子间可以形成氢键,使分子间作用力增大;
(4)根据上面分析知D与B形成的离子化合物的化学式为CaF2;
(5)根据焰色反应判断Ca的焰色反应为砖红色;原理是激发态电子从能量较高的轨道跃迁到能量较低的轨道,以光的形式释放出能量。

【题目】下列我国科研成果所涉及材料中,主要成分为同主族元素形成的无机非金属材料的是
|
|
|
|
A.4.03米大口径碳化硅反射镜 | B.2022年冬奥会聚氨酯速滑服 | C.能屏蔽电磁波的碳包覆银纳米线 | D.“玉兔二号”钛合金筛网轮 |
A. AB. BC. CD. D
【题目】锂辉石(主要成分为LiAl(SiO3)2,还含有Fe2O3、MgO、Al2O3等杂质)是最重要的提锂矿石原料,工业上以![]() -锂辉石为原料制备碳酸锂,其工艺流程如下:
-锂辉石为原料制备碳酸锂,其工艺流程如下:
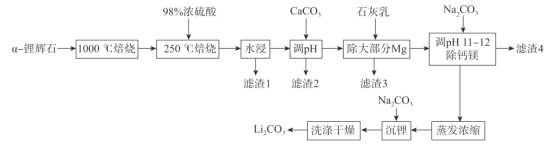
已知:①![]() -锂辉石化学惰性大,除HF外,几乎不与任何酸碱反应,
-锂辉石化学惰性大,除HF外,几乎不与任何酸碱反应, ![]() -锂辉石在高温下可转化为β一锂辉石,β一锂辉石具有更高的化学活性。
-锂辉石在高温下可转化为β一锂辉石,β一锂辉石具有更高的化学活性。
②β一锂辉石可与浓硫酸发生反应:2β一LiAl(SiO3)2+ H2SO4(浓)![]() Li2SO4 +Al2O3·4SiO2·H2O。
Li2SO4 +Al2O3·4SiO2·H2O。
③部分金属氢氧化物开始沉淀和完全沉淀的pH如表:
氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
开始沉淀pH | 2.7 | 3.7 | 9.6 |
完全沉淀pH | 3.7 | 4.7 | 11 |
请回答下列问题:
(1)将LiAl(SiO3)2改写成氧化物的形式为_______,1000 °C焙烧![]() -锂辉石的目的为_____.
-锂辉石的目的为_____.
(2)滤渣2的主要成分为________调节pH值的范围为________。
(3)“除大部分Mg”步骤的离子方程式为______________。
(4)实验室蒸发浓缩操作中所需的仪器为酒精灯、铁架台(带铁圈)、______________。
(5)洗涤过程中检验沉淀是否洗涤干净的操作为________________________________。
(6)碳酸锂是制备锂离子电池的原料之一,某锂离子电池以CoP3作为负极材料,以LiM1.5Ni0.5O4作为正极材料,以可传导Li+的无机固体电解质c-LATP作为电解液,其工作时电池反应为Li1-x Mn0.5Ni0.5O4 + Lix(CoP3 )![]() LiMn1.5Ni0.5O4+(CoP3),则该电池放电时负极的电极反应式为_________________,充电时阳极的电极反应式为_____________。
LiMn1.5Ni0.5O4+(CoP3),则该电池放电时负极的电极反应式为_________________,充电时阳极的电极反应式为_____________。
【题目】(1)实验测得16g甲醇[CH3OH(l)]在氧气中充分燃烧生成二氧化碳气体和液态水时释放出363.25kJ的热量,试写出甲醇燃烧热的热化学方程式:_______________________.
(2)从化学键的角度分析,化学反应的过程就是反应物的化学键被破坏和生成物的化学键的形成过程.已知反应:N2(g)+3H2(g)2NH3(g)△H=a kJmol﹣1.有关键能数据如表:
化学键 | H-H | N-H | N≡N |
键能(kJ/mol) | 436 | 391 | 945 |
试根据表中所列键能数据估算a的数值_______________.
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的反应热进行推算.已知:
C(s,石墨)+O2(g)═CO2(g) △H1=﹣393.5kJmol﹣1
2H2(g)+O2(g)═2H2O(l) △H2=﹣571.6kJmol﹣1
2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l) △H3=﹣2599kJmol﹣1
根据盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1mol C2H2(g)反应的反应热为:△H=____________________.
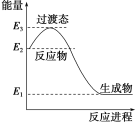
(4)在微生物作用下,NH4+经过两步反应被氧化成NO3﹣。两步反应的能量变化示意图如图:
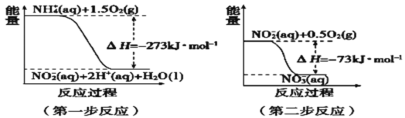
第一步反应是________反应(填“放热”或“吸热”),原因是_________________________