题目内容
9. 实验课上配制500mL 0.5mol/L的NaOH溶液,试回答下列问题.
实验课上配制500mL 0.5mol/L的NaOH溶液,试回答下列问题.(1)计算:需要NaOH固体的质量为10.0g.
(2)某学生用托盘天平称量小烧杯的质量(烧杯中盛NaOH),称量前把游码放在标尺的零刻度,天平静止时发现指针在分度盘的偏右位置,此时左边的托盘将高于(填“高于”或“低于”)右边的托盘,欲使天平平衡,所进行的操作为将左边的横梁螺丝往外调以调节平衡.假定最终称量小烧杯的质量为32.6g(填“32.6g”或“32.61g”).
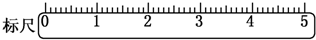
(3)在标尺(图)上画出游码位置(画“△”表示).
(4)配制方法:设计五个操作步骤
①向盛有NaOH的烧杯中加入200mL蒸馏水使其溶解,并冷却至室温;
②继续向容量瓶中加入蒸馏水至离液面刻度1~2cm;
③将NaOH溶液沿玻璃棒注入500mL容量瓶中;
④在烧杯中加入少量蒸馏水,小心洗涤2~3次后移入容量瓶中;
⑤改用胶头滴管加入蒸馏水至刻度线,加盖摇匀.
试用以上编号写出正确顺序①③④②⑤.
(5)某学生实际配制NaOH溶液的浓度为0.48mol/L,原因可能是ACD
A.使用滤纸称量NaOH固体
B.容量瓶中原来存有少量水
C.溶解后的烧杯未经多次洗涤
D.用胶头滴管加水定容时仰视刻度.
分析 (1)利用n=cV计算出氢氧化钠的物质的量,再根据m=nM计算所需氢氧化钠的质量;
(2)托盘天平的精确度为0.1g,分度盘的指针偏右,说明右边重,将左边的横梁螺丝往外调调节平衡;
(3)根据称量质量判断游码读数,然后在标尺上画出游码的位置;
(4)根据配制溶液的实验操作过程进行实验步骤排序;
(5)分析操作对溶质的物质的量或对溶液的体积的影响,根据c=$\frac{n}{V}$分析判断.
解答 解:(1)需氢氧化钠的质量为:m(NaOH)=0.5L×0.5mol•L-1×40g/mol=10.0g,
故答案为:10.0g;
(2)分度盘的指针偏右,说明右边重,左盘高于右盘.应将左边的横梁螺丝往外调以调节平衡.托盘天平的精确度为0.1g,故称量的质量应该为32.6g,
故答案为:高于;将左边的横梁螺丝往外调以调节平衡;32.6g;
(3)称量的总质量为32.6g,需要用到游码的读数为2.6g,则在标尺上画出游码的位置为: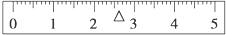 ,
,
故答案为: ;
;
(4)操作步骤有计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解(可用量筒量取水加入烧杯),并用玻璃棒搅拌,加速溶解.冷却后转移到500mL容量瓶中,并用玻璃棒引流,洗涤烧杯、玻璃棒2-3次,并将洗涤液移入容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.所以正确操作顺序为①③④②⑤,
故答案为:①③④②⑤;
(5)实际配制NaOH溶液的浓度0.48mol•L-1,所配溶液浓度偏低,
A.用滤纸称量时,滤纸会吸附氢氧化钠,所以转入烧杯的氢氧化钠也少了,所配溶液浓度偏低,故A正确;
B.最后需要定容,容量瓶不干燥,含有少量蒸馏水,对溶液浓度无影响,故B错误;
C.未洗涤液烧杯、玻璃棒,移入容量瓶中氢氧化钠的实际质量减小,溶液浓度偏低,故C正确;
D.定容时仰视刻度,使溶液的体积偏大,所配溶液浓度偏低,故D正确;
故答案为:ACD.
点评 本题考查了配制一定物质的量浓度的步骤及误差分析,题目难度不大,掌握配制一定物质的量浓度的溶液的基本步骤,明确误差分析的方法与技巧.

 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案| A. | 离子键 | B. | 氢键 | C. | 非极性键 | D. | 范德华力 |
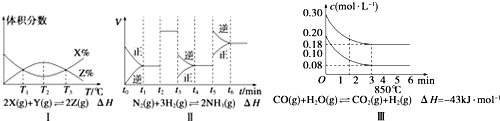
| A. | 由图Ⅰ知,反应在T1、T3处达到平衡,且该反应的△H<0 | |
| B. | 由图Ⅱ知,反应在t6时刻,NH3体积分数最大 | |
| C. | 由图Ⅱ知,t3时采取降低反应体系压强的措施 | |
| D. | 图Ⅲ表示在10 L容器、850℃时的反应,由图知,到4 min时,反应放出51.6 kJ的热量 |
| A. | 热稳定性:纯碱>石灰石>小苏打>碳酸 | |
| B. | 除Li外其它碱金属单质均可以保存在煤油中 | |
| C. | 碱金属都是活泼的金属元素,其盐都不发生水解 | |
| D. | 最高氧化物对应水化物碱性LiOH<NaOH<KOH<RbOH<CsOH |
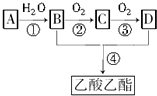
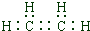 .
. CH3COOCH2CH3+H2O,属于取代反应.
CH3COOCH2CH3+H2O,属于取代反应.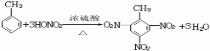 ,此反应属于取代反应,其生成物的名称是2.4.6-三硝基甲苯
,此反应属于取代反应,其生成物的名称是2.4.6-三硝基甲苯