题目内容
【题目】NaCl和NaClO在酸性条件下可发生反应:ClO-+ Cl-+2H+![]() Cl2↑+H2O,某学习小组拟研究消毒液(主要成分为NaCl和NaClO)的变质情况。
Cl2↑+H2O,某学习小组拟研究消毒液(主要成分为NaCl和NaClO)的变质情况。
(1)此消毒液中NaClO可吸收空气中的CO2生成NaHCO3和HClO而变质。写出化学反应方程式: 。
(2)取适量消毒液放在试管中,加入足量一定浓度的硫酸,有气体放出。通过以下装置检验气体的成分,从而判断该消毒液是否变质。
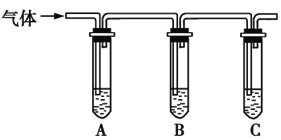
限选试剂:98%浓硫酸、1%品红溶液、1.0 mol·L-1KI-淀粉溶液、1.0 mol·L-1NaOH溶液、澄清石灰水、饱和NaCl溶液。
请完成下列实验方案。
所加试剂 | 预期现象和结论 |
向试管A中加足量①; | 若A中溶液变蓝色,B中溶液不褪色,C中溶液变浑浊,则消毒液部分变质; |
(3)用滴定法测定消毒液中NaClO的浓度。实验步骤如下:
①量取 25.00 mL消毒液放入锥形瓶中,加入过量的a mol·L-1Na2SO3溶液b mL。
②滴定分析。将c mol·L-1的酸性KMnO4溶液装入 (填“酸式”或“碱式”)滴定管中滴定,使KMnO4和剩余的Na2SO3发生反应。当溶液由无色变成浅红色,且半分钟内红色保持不褪去时,停止滴定,记录数据。重复滴定实验3次,测得平均消耗酸性KMnO4溶液V mL;滴定过程中涉及的反应有:NaClO+Na2SO3![]() NaCl+Na2SO4 ;2KMnO4+5Na2SO3+3H2SO4
NaCl+Na2SO4 ;2KMnO4+5Na2SO3+3H2SO4![]() K2SO4+2MnSO4+5Na2SO4+3H2O。
K2SO4+2MnSO4+5Na2SO4+3H2O。
③计算。消毒液中NaClO的浓度为 mol·L-1(用含a、b、c、V的代数式表示)。
【答案】(1)NaClO+CO2+H2O![]() NaHCO3+HClO
NaHCO3+HClO
(2)
所加试剂 | 预期现象和结论 |
①1.0 mol/L KI-淀粉溶液 | ③若A中溶液变蓝色,B中溶液不褪色(无变化),C中溶液不变浑浊(无变化) |
(3)②酸式 ③(2ab-5Vc)/50
【解析】(1)对比提示的反应物NaClO、CO2与生成物NaHCO3、HClO,由元素守恒可知反应物中还有 H2O。(2)根据表格中“若A中溶液变蓝色”及提供的限选试剂可知,试管A中为足量的1.0 mol/L KI-淀粉溶液,“若……C中溶液变浑浊”则表明试管C中为澄清石灰水。若消毒液部分变质,则其中既含NaClO,又含NaHCO3,加酸后生成Cl2和CO2,前者使KI氧化,生成I2,A中溶液变蓝,又因为1.0 mol/L KI-淀粉溶液足量,故装置B中的品红不变色,CO2使装置C中的澄清石灰水变浑浊;若消毒液未变质,则加入酸只有Cl2生成,故只有装置A中有蓝色现象;若消毒液全部变质,则只生成CO2,即只有装置C中有沉淀现象。(3)酸性KMnO4溶液具有强氧化性,会腐蚀碱式滴定管的橡胶管,故只能用酸式滴定管盛装。由已知化学方程式可知关系式:2KMnO4~5Na2SO3和NaClO~Na2SO3。所以a×b=25×c(NaClO)+c×V,因此c(NaClO)=(2ab-5Vc)/50 mol·L-1。

 阅读快车系列答案
阅读快车系列答案