题目内容
【题目】下列各组离子因发生氧化还原反应而不能大量共存的是( )
A.H+、Fe2+、NO3﹣、SO42﹣
B.Al3+、Na+、SO42﹣、HCO3﹣
C.Na+、Ca2+、Cl﹣、SO42﹣
D.Fe3+、K+、SCN﹣、Cl﹣
【答案】A
【解析】
试题分析:A.H+、Fe2+、NO3-发生氧化还原反应,则不能共存,故A选;B.Al3+、HCO3-相互促进水解,不能共存,故B不选;C.Cu2+、S2-结合生成沉淀,因复分解反应而不能共存,故C不选;D.Fe3+、SCN-结合生成络离子,则不能共存,故D不选;故选A。

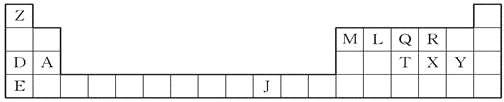
【题目】A、B、C、D、E是周期表中前四周期的元素,其有关性质或结构信息如下表:
元素 | 有关性质或结构信息 |
A | 负二价的A元素的氢化物在通常状况下是一种液体,其中A的质量分数为88.9% |
B | B原子得到一个电子后3p轨道全充满 |
C | C原子的p轨道半充满,它的气态氢化物能与其最高价氧化物的水化物反应生成一种常见的盐X |
D | D元素的最高化合价与最低化合价的代数和为零,其最高价氧化物水化物的酸性为同主族最强 |
E | E元素的核电荷数等于A原子的核电荷数和B元素氢化物的核电荷数之和 |
(1)元素Y是C下一周期同主族元素,比较B、Y元素的第一电离能I1(B) I1(Y)(填“>”“=”或“<”);
(2)盐X的水溶液呈 (填“酸性”“碱性”或“中性”) ,原因________________(用离子方程式表示);
(3)E元素原子的核外电子排布式为_____________,在周期表中的位置______________;
(4)C单质分子中σ键和π键的个数比为 ,C的氢化物在同族元素的氢化物中沸点出现反常,其原因是____________________________________________;
(5)用高能射线照射液态H2A时,一个H2A分子能释放出一个电子,同时产生一种具有较强氧化性的阳离子,试写出该阳离子的电子式: ,写出该阳离子与硫的氢化物的水溶液反应的离子方程式:_________________________________________。