题目内容
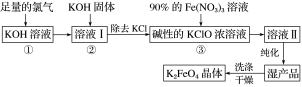
【题目】在容积不同的密闭容器内,分别充入同量的N2和H2,在不同温度下,任其发生反应N2+3H2![]() 2NH3,并分别在t秒时测定其中NH3的体积分数,绘图如下:
2NH3,并分别在t秒时测定其中NH3的体积分数,绘图如下:
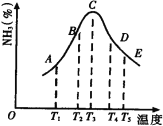
(1)A,B,C,D,E五点中,尚未达到化学平衡状态的点是_______。
(2)此可逆反应的正反应是______反应。(放热、吸热)
(3)AC段的曲线是增函数,CE段曲线是减函数,试从反应速率和平衡角度说明理由。 ____________________________________
【答案】(1)A、B;(2)放热;(3)AC:反应开始v正>v逆,反应向右进行生成NH3;CE:反应平衡后升温,向吸热方向移动NH3减少。
【解析】
试题分析:(1)达到化学平衡时达到最大限度,即C达到化学平衡,D、E温度对化学平衡的影响,也达到化学平衡,A、B是反应向正反应方向进行,还没达到化学平衡,故A、B未达到化学平衡;(2)此图像看C点以后,随着温度升高生成物的体积分数降低,根据勒夏特列原理,升高温度,平衡向吸热反应方向移动,说明正反应方向是放热反应;(3)AC:反应反应开始v正>v逆,反应向右进行生成NH3;CE:反应平衡后升温,向吸热方向移动NH3减少。

【题目】A、B、C、D、E是周期表中前四周期的元素,其有关性质或结构信息如下表:
元素 | 有关性质或结构信息 |
A | 负二价的A元素的氢化物在通常状况下是一种液体,其中A的质量分数为88.9% |
B | B原子得到一个电子后3p轨道全充满 |
C | C原子的p轨道半充满,它的气态氢化物能与其最高价氧化物的水化物反应生成一种常见的盐X |
D | D元素的最高化合价与最低化合价的代数和为零,其最高价氧化物水化物的酸性为同主族最强 |
E | E元素的核电荷数等于A原子的核电荷数和B元素氢化物的核电荷数之和 |
(1)元素Y是C下一周期同主族元素,比较B、Y元素的第一电离能I1(B) I1(Y)(填“>”“=”或“<”);
(2)盐X的水溶液呈 (填“酸性”“碱性”或“中性”) ,原因________________(用离子方程式表示);
(3)E元素原子的核外电子排布式为_____________,在周期表中的位置______________;
(4)C单质分子中σ键和π键的个数比为 ,C的氢化物在同族元素的氢化物中沸点出现反常,其原因是____________________________________________;
(5)用高能射线照射液态H2A时,一个H2A分子能释放出一个电子,同时产生一种具有较强氧化性的阳离子,试写出该阳离子的电子式: ,写出该阳离子与硫的氢化物的水溶液反应的离子方程式:_________________________________________。