题目内容
3. 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解9.6g.向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示 (已知硝酸只被还原为NO气体).
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解9.6g.向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示 (已知硝酸只被还原为NO气体).(1)原溶液中NO3-的物质的量为0.2mol.
(2)加铁粉过程中,生成的气体在标准状况下的体积为4.48L
(3)H2SO4浓度2.5mol•L-1.
分析 由图象可知,OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,AB段发生反应为:Fe+2Fe3+=3Fe2+,BC段发生反应为:Fe+2H+=Fe2++H2↑.
(1)OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,硝酸全部起氧化剂作用,根据铁的物质的量计算每一份溶液中NO3-的物质的量,原溶液中NO3-的物质的量为每一份中的2倍;
(2)OA段生成NO,BC段生成氢气,结合方程式计算;
(3)最终消耗14gFe,溶液中溶质为FeSO4,根据Fe元素守恒可以计算n(FeSO4),再根据硫酸根守恒计算每一份溶液中n(H2SO4),进而计算硫酸的物质的量浓度.
解答 解:由图象可知,OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,AB段发生反应为:Fe+2Fe3+=3Fe2+,BC段发生反应为:Fe+2H+=Fe2++H2↑.
(1)OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,硝酸全部起氧化剂作用,原溶液中NO3-的物质的量为每一份中的2倍,所以原溶液中n(NO3-)=2n(Fe)=2×$\frac{5.6g}{56g/mol}$=0.2mol,故答案为:0.2mol;
(2)OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,由方程式可知,生成的n(NO)=n(Fe)=$\frac{5.6g}{56g/mol}$=0.1mol,BC段发生反应为:Fe+2H+=Fe2++H2↑,由方程式可知生成的n(H2)=n(Fe)=0.1mol,故整个过程中生成气体为(0.1mol+0.1mol)×22.4L/mol=4.48L,故答案为:4.48L;
(3)最终消耗14gFe,其物质的量为$\frac{14g}{56g/mol}$=0.25mol,溶液中溶质为FeSO4,根据Fe元素守恒可n(FeSO4)=n(Fe)=0.25mol,再根据硫酸根守恒,每一份溶液中n(H2SO4)=n(FeSO4)=0.25mol,故原硫酸的物质的量浓度为$\frac{0.25mol}{0.1L}$=2.5mol/L,故答案为:2.5.
点评 本题以化学反应图象为载体,考查有关金属和酸反应的计算,难度较大,关键根据图象分析各段发生的反应,注意与铁的反应中硝酸全部起氧化剂作用.

 备战中考寒假系列答案
备战中考寒假系列答案| A. | 乙醇、乙二醇、丙三醇互为同系物,同系物之间不可能为同分异物体 | |
| B. | 北京奥运会奖牌--“金镶玉”奖牌玉的化学成分多为含水钙镁硅酸盐,如:Ca2Mg5Si8O22(OH)2可用氧化物表示为:2CaO•5MgO•8SiO2•H2O | |
| C. | 次氯酸的结构式为:H-Cl-O | |
| D. | 丙烷分子的比例模型示意图: |
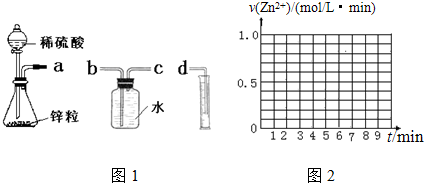
(1)为达到本实验目的其装置连接顺序为:a连c,b连d.
(2)实验开始后,锥形瓶中发生反应的离子方程式为Zn+2H+═Zn2++H2↑.
(3)两套装置的分液漏斗所装的试剂分别为1mol/L硫酸溶液和4mol/L硫酸溶液,该小组同学要测定并记录的数据如下表:
| 加入的试剂 | H2的体积(相同条件下) | 反应时间 | 反应速率 |
| 1mol/L硫酸溶液 | 10mL | t1 | v1 |
| 4mol/L硫酸溶液 | 10mL | t2 | v2 |
(4)另有一组同学测定了每隔一分钟,锥形瓶中硫酸的浓度,记录结果如下:
| 时间(min) | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 硫酸浓度(mol/L) | 4.0 | 3.8 | 3.5 | 3.1 | 2.6 | 2.2 | 1.9 | 1.8 | … |
请解释0到4mim时该化学反应速率随时间变化的原因:该反应为放热反应,随反应的进行,温度不断升高,所以反应速率不断加快.
(5)除上述实验方案可定量测定该反应的化学反应速率外,还可能有的实验测定方案有:相同时间内测定生成H2的体积;相同时间内测定Zn的质量(任写一种).
| 污染指数 | 首要污染物 | 空气质量级别 | 空气质量状况 |
| 55 | SO2 | II | 良 |
(1)用下图所示装置进行实验.
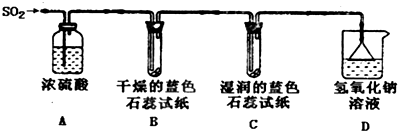
①A装置的作用是干燥.
②实验过程中,B装置内石蕊试纸的颜色没有发生变化,C装置内湿润的蓝色石蕊试纸变成红色,说明SO2与水反应生成一种酸,其化学反应方程式是S02+H20?H2S03.
③D装置的作用是吸收多余SO2气体,避免污染空气,
D中发生反应的化学方程式是S02+2NaOH=Na2S03+H20.
(2)往盛有水的烧杯中通入SO2气体,测得所得溶液的pH<7(填“>”“=”或“<”),然后每隔1h测定其pH,发现pH逐渐变小(填“变大”或“变小”),直至恒定,原因是2H2SO3+O2=4H++2SO42-(写出反应的离子方程式).
(3)SO2形成酸雨的另一途径为:SO2与空气中的O2在飘尘的作用下反应生成SO3,SO3溶于降水生成H2SO4,则在此过程中的飘尘是作为催化剂(填“催化剂”或“氧化剂”).
(4)SO2与空气中的氧气、水反应生成硫酸而形成酸雨.该市可能易出现酸雨.汽车排放的尾气,硝酸、化肥等工业生产排出的废气中都含有氮的氧化物,氮的氧化物溶于水最终转化为HNO3,是造成酸雨的另一主要原因.
| A. | K2[Co(NCS)3]Cl | B. | Na2[SiF2Cl2Br2] | C. | Na3[AlF6] | D. | [Cr(NH3)4(H2O)2]Cl3 |

 X、Y、Z、W、R是原子序数依次增大的前四周期元素.X的单质在Y2中燃烧可生成XY和XY2两种气体;Z的单质在Y2中燃烧的产物ZY2可使品红溶液褪色;W的单质是黄绿色的有毒气体;R3+离子的3d轨道半充满.请回答下列问题:
X、Y、Z、W、R是原子序数依次增大的前四周期元素.X的单质在Y2中燃烧可生成XY和XY2两种气体;Z的单质在Y2中燃烧的产物ZY2可使品红溶液褪色;W的单质是黄绿色的有毒气体;R3+离子的3d轨道半充满.请回答下列问题: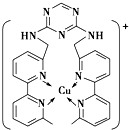 铜、碳、氮、硫、氯等是组成物质的重要元素.
铜、碳、氮、硫、氯等是组成物质的重要元素.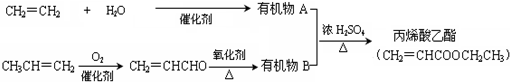
 ,反应类型是加聚反应.
,反应类型是加聚反应.